よむ、つかう、まなぶ。
【参考資料1-1】薬機法改正概要 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
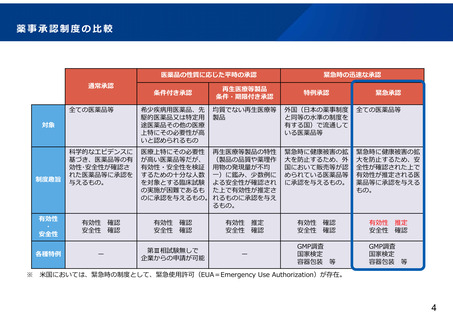
緊 急 承 認 制 度 に お け る 承 認 審 査 の 考 え 方 ( ガ イ ド ラ イ ン ) に つ い て (概要)
緊急承認制度における承認審査の考え方については、主に以下のような内容をガイドラインとして課長通知において規定。
(「緊急承認制度における承認審査の考え方について」(令和4年5月20日付け薬生薬審発0520 第1号))
有効性・安全性の評価
• 緊急時におけるリスクとベネフィットのバランスを考慮し、有効性を推定す
るために必要な臨床試験成績に基づき、推定される有効性に比して、安全性
が許容可能であることを確認する必要がある。
• 感染症の治療薬とワクチンについては具体的には次のとおり。
治療薬
• 探索的な臨床試験において、臨床的意義の認められた評価指標により一定
の有効性が示されている場合が想定。
• 探索的な臨床試験としては、通常は、後期第Ⅱ相試験程度の臨床試験が該
当。
• 外来因子であるウイルスをターゲットとする抗体医薬品などの場合は、日
本人成績は必要でない場合がある。
ワクチン
• 代替指標の臨床的意義が明らかになっていない場合は、発症予防効果を評
価指標とした検証的な第Ⅲ相臨床試験が原則。ただし、第Ⅲ相臨床試験の
中間解析等の段階で有効性を推定できる場合は想定される。
※
なお、今後の技術革新等を否定するものではない。
• 海外の検証的な大規模臨床試験で顕著な成績が得られている場合には、日
本国内での臨床試験成績は必要ではない場合がある。
適用の要件
緊急性の要件
• 最も想定されるのは感染症のアウトブレイク
• 原子力事故、放射能汚染、バイオテロ等も想定
代替性の要件
• ①既承認薬がない、②既承認薬はあるが複数の治療選択肢が
必要、③供給が不十分、④極めて高い有効性・安全性が見込
まれること、のいずれかに該当すること。
• ②の例としては、作用機序が異なる場合や、禁忌の対象が異
なる場合等が含まれる。
期限内の本承認申請の際の取扱い
• 有効性確認のため、原則として検証的な第Ⅲ相臨床試験が必要。
• 感染者が急速に減少するなど、検証的な第Ⅲ相臨床試験の完遂
が困難であると合理的に考えられる場合その他の場合には、リ
アルワールドデータを活用して有効性の確認を行う方法を検討
できる場合がある。
その他
• 申請資料、猶予資料の取扱い、GCP調査・GMP調査の取扱い、
期限、機構における審査の取扱いについて規定
8
緊急承認制度における承認審査の考え方については、主に以下のような内容をガイドラインとして課長通知において規定。
(「緊急承認制度における承認審査の考え方について」(令和4年5月20日付け薬生薬審発0520 第1号))
有効性・安全性の評価
• 緊急時におけるリスクとベネフィットのバランスを考慮し、有効性を推定す
るために必要な臨床試験成績に基づき、推定される有効性に比して、安全性
が許容可能であることを確認する必要がある。
• 感染症の治療薬とワクチンについては具体的には次のとおり。
治療薬
• 探索的な臨床試験において、臨床的意義の認められた評価指標により一定
の有効性が示されている場合が想定。
• 探索的な臨床試験としては、通常は、後期第Ⅱ相試験程度の臨床試験が該
当。
• 外来因子であるウイルスをターゲットとする抗体医薬品などの場合は、日
本人成績は必要でない場合がある。
ワクチン
• 代替指標の臨床的意義が明らかになっていない場合は、発症予防効果を評
価指標とした検証的な第Ⅲ相臨床試験が原則。ただし、第Ⅲ相臨床試験の
中間解析等の段階で有効性を推定できる場合は想定される。
※
なお、今後の技術革新等を否定するものではない。
• 海外の検証的な大規模臨床試験で顕著な成績が得られている場合には、日
本国内での臨床試験成績は必要ではない場合がある。
適用の要件
緊急性の要件
• 最も想定されるのは感染症のアウトブレイク
• 原子力事故、放射能汚染、バイオテロ等も想定
代替性の要件
• ①既承認薬がない、②既承認薬はあるが複数の治療選択肢が
必要、③供給が不十分、④極めて高い有効性・安全性が見込
まれること、のいずれかに該当すること。
• ②の例としては、作用機序が異なる場合や、禁忌の対象が異
なる場合等が含まれる。
期限内の本承認申請の際の取扱い
• 有効性確認のため、原則として検証的な第Ⅲ相臨床試験が必要。
• 感染者が急速に減少するなど、検証的な第Ⅲ相臨床試験の完遂
が困難であると合理的に考えられる場合その他の場合には、リ
アルワールドデータを活用して有効性の確認を行う方法を検討
できる場合がある。
その他
• 申請資料、猶予資料の取扱い、GCP調査・GMP調査の取扱い、
期限、機構における審査の取扱いについて規定
8