よむ、つかう、まなぶ。
15参考資料2-5 百日せきワクチン ファクトシート 平成 29(2017)年 2 月 10 日 (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000192554_00024.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会 予防接種基本方針部会(第49回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
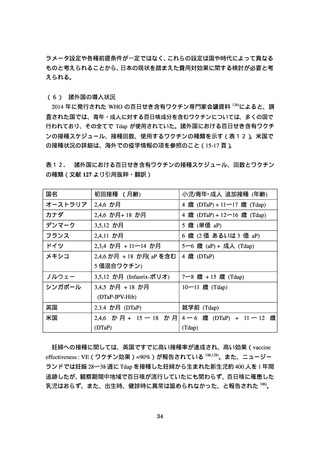
従って、11〜12 歳及び青年・成人層で DTaP を接種した場合、次の追加免疫の必要性に
ついては現時点では評価できない。
(4) 安全性の観点(副反応の頻度、重篤な副反応等)
①
国内での検討
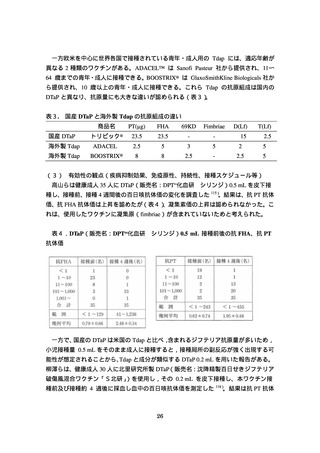
DTaP 追加接種の安全性を検討するために、第 1 期として 3〜4 回の DTaP 接種歴があ
る 11〜12 歳児 445 人を対象として国内第Ⅲ相臨床試験が実施された(阪大微研:
CTD5.3.5.1-1:BKD1A 試験)119)。参加者を DTaP 0.5 mL 接種群(223 人)と DT 0.1 mL
接種群(222 人)にランダムに割り付け、接種から 28 日後あるいは 42 日後までに発現
した副反応・有害事象の頻度を比較した。
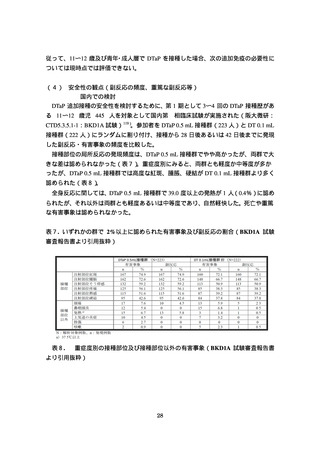
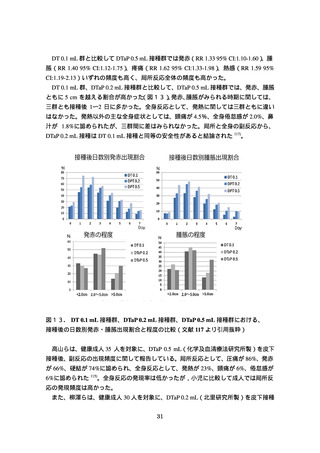
接種部位の局所反応の発現頻度は、DTaP 0.5 mL 接種群でやや高かったが、両群で大
きな差は認められなかった(表7)。重症度別にみると、両群とも軽度か中等度が多か
ったが、DTaP 0.5 mL 接種群では高度な紅斑、腫脹、硬結が DT 0.1 mL 接種群より多く
認められた(表8)。
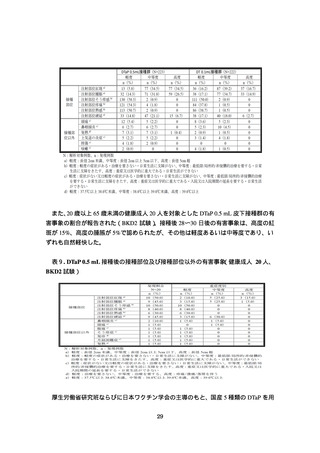
全身反応に関しては、DTaP 0.5 mL 接種群で 39.0 度以上の発熱が 1 人(0.4%)に認め
られたが、それ以外は両群とも軽度あるいは中等度であり、自然軽快した。死亡や重篤
な有害事象は認められなかった。
表7. いずれかの群で 2%以上に認められた有害事象及び副反応の割合(BKD1A 試験
審査報告書より引用抜粋)
表8.
重症度別の接種部位及び接種部位以外の有害事象(BKD1A 試験審査報告書
より引用抜粋)
28
ついては現時点では評価できない。
(4) 安全性の観点(副反応の頻度、重篤な副反応等)
①
国内での検討
DTaP 追加接種の安全性を検討するために、第 1 期として 3〜4 回の DTaP 接種歴があ
る 11〜12 歳児 445 人を対象として国内第Ⅲ相臨床試験が実施された(阪大微研:
CTD5.3.5.1-1:BKD1A 試験)119)。参加者を DTaP 0.5 mL 接種群(223 人)と DT 0.1 mL
接種群(222 人)にランダムに割り付け、接種から 28 日後あるいは 42 日後までに発現
した副反応・有害事象の頻度を比較した。
接種部位の局所反応の発現頻度は、DTaP 0.5 mL 接種群でやや高かったが、両群で大
きな差は認められなかった(表7)。重症度別にみると、両群とも軽度か中等度が多か
ったが、DTaP 0.5 mL 接種群では高度な紅斑、腫脹、硬結が DT 0.1 mL 接種群より多く
認められた(表8)。
全身反応に関しては、DTaP 0.5 mL 接種群で 39.0 度以上の発熱が 1 人(0.4%)に認め
られたが、それ以外は両群とも軽度あるいは中等度であり、自然軽快した。死亡や重篤
な有害事象は認められなかった。
表7. いずれかの群で 2%以上に認められた有害事象及び副反応の割合(BKD1A 試験
審査報告書より引用抜粋)
表8.
重症度別の接種部位及び接種部位以外の有害事象(BKD1A 試験審査報告書
より引用抜粋)
28