よむ、つかう、まなぶ。
医薬品・医療機器等安全性情報395号 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/iyaku/index.html |
| 出典情報 | 医薬品・医療機器等安全性情報395号(9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
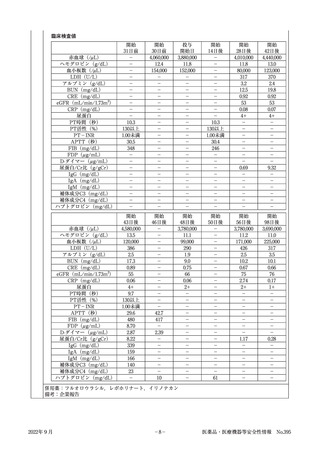
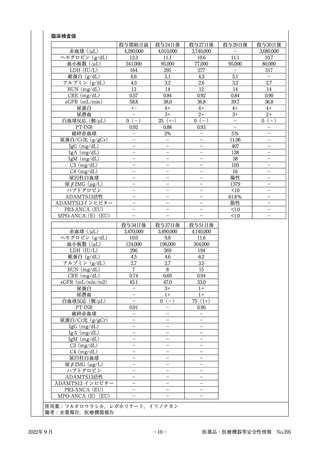
〔症例概要〕
患者
No.
性・
年齢
2
女 S字結腸癌
430mg
40代 (肝転移,骨 (2週おきに
転移,
肺転移, 2クール)
リンパ節転移)
使用理由
(合併症)
副作用
1日投与量
投与期間
経過及び処置
血栓性微小血管症
投与開始
約9か月前
投与開始
約1か月前
投与開始
30日前
投与開始日
S状結腸癌に対し,FOLFOX療法開始。
S状結腸癌に対し,FOLFOXIRI療法開始。
赤血球:4,060,000/μL,ヘモグロビン:12.4g/dL,血小板:
154,000/μL
S状結腸癌(腺癌,T4aN3M1)に対し,FOLFIRI療法+本
剤の投与開始。
赤血球:3,880,000/μL,ヘモグロビン:11.8g/dL,血小板:
152,000/μL
開始数日後 浮腫,血圧上昇,体重増加傾向認める。
開始14日後 FOLFIRI療法+本剤の投与。
(本剤最終投与日)
開始28日後 Alb3.2g/dLのため,FOLFIRI療法+本剤の投与延期。
(投与中止日) 赤血球:4,010,000/μL,ヘモグロビン:11.8g/dL,血小板:
80,000/μL,eGFR:53mL/min/1.73m2,尿蛋白:4+
中止14日後 ネフローゼ症候群が疑われ腎臓内科受診。
赤血球:4,440,000/μL,ヘモグロビン:13.0g/dL,血小板:
123,000/μL,eGFR:53mL/min/1.73m2,尿蛋白:4+
中止15日後 ネフローゼ症候群の診断。精査加療のために入院。塩分制
限,フロセミド,アムロジピン,カンデサルタンで治療開始。
Hb:13.5g/dL,破砕赤血球なし。
血液検査,尿検査上,二次性腎炎を示唆する所見なし。
赤血球:4,580,000/μL,ヘモグロビン:13.5g/dL,血小板:
120,000/μL,eGFR:55mL/min/1.73m2,尿蛋白:4+
中止18日後 ハプトグロビン:10mg/dL以下
中止20日後 一次性腎炎または本剤によるネフローゼ症候群を疑い,腎生
検を実施。
【光顕所見】
巣状分節性にメサンギウム領域の拡大,係蹄内の泡沫細胞浸
潤,内皮下からメサンギウム領域にMasson染色で赤紫する
沈着物を認めた。また,糸球体基底膜の二重化を多数認めた。
間質はやや浮腫状で,一部に繊維化と細胞浸潤を認め,所々
に尿細管上皮の空胞変性像を認めた。
【蛍光所見】
IgM,C4が糸球体基底膜に一致してfringe patternでの発光
を示していた。
【病理組織】
慢性増殖性糸球体腎炎様病変であり,TMA(血栓性微小血
管症)様病変と一致。
以上より,本剤による薬剤性ネフローゼ症候群と診断された。
赤血球:3,780,000/μL,ヘモグロビン:11.1g/dL,血小板:
99,000/μL,eGFR:66mL/min/1.73m2,尿蛋白:2+
中止22日後 ハプトグロビン61mg/dL
中止28日後 本剤の中止及びカンデサルタンの投与により蛋白尿が軽快し
退院。
赤血球:3,780,000/μL,ヘモグロビン:11.2g/dL,血小板:
171,000/μL,eGFR:75mL/min/1.73m2,尿蛋白:2+
中止70日後 薬剤性ネフローゼ症候群について完全寛解を得た。
赤血球:3,690,000/μL,ヘモグロビン:11.0g/dL,血小板:
225,000/μL,eGFR:76mL/min/1.73m2,尿蛋白:1+
医薬品・医療機器等安全性情報
No.395
-7-
2022年9月
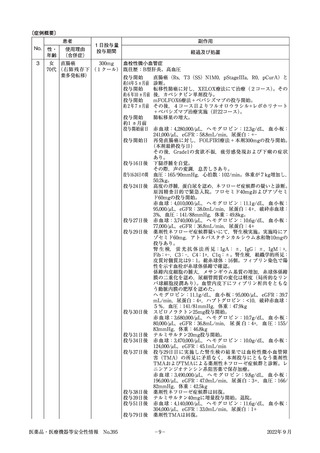
患者
No.
性・
年齢
2
女 S字結腸癌
430mg
40代 (肝転移,骨 (2週おきに
転移,
肺転移, 2クール)
リンパ節転移)
使用理由
(合併症)
副作用
1日投与量
投与期間
経過及び処置
血栓性微小血管症
投与開始
約9か月前
投与開始
約1か月前
投与開始
30日前
投与開始日
S状結腸癌に対し,FOLFOX療法開始。
S状結腸癌に対し,FOLFOXIRI療法開始。
赤血球:4,060,000/μL,ヘモグロビン:12.4g/dL,血小板:
154,000/μL
S状結腸癌(腺癌,T4aN3M1)に対し,FOLFIRI療法+本
剤の投与開始。
赤血球:3,880,000/μL,ヘモグロビン:11.8g/dL,血小板:
152,000/μL
開始数日後 浮腫,血圧上昇,体重増加傾向認める。
開始14日後 FOLFIRI療法+本剤の投与。
(本剤最終投与日)
開始28日後 Alb3.2g/dLのため,FOLFIRI療法+本剤の投与延期。
(投与中止日) 赤血球:4,010,000/μL,ヘモグロビン:11.8g/dL,血小板:
80,000/μL,eGFR:53mL/min/1.73m2,尿蛋白:4+
中止14日後 ネフローゼ症候群が疑われ腎臓内科受診。
赤血球:4,440,000/μL,ヘモグロビン:13.0g/dL,血小板:
123,000/μL,eGFR:53mL/min/1.73m2,尿蛋白:4+
中止15日後 ネフローゼ症候群の診断。精査加療のために入院。塩分制
限,フロセミド,アムロジピン,カンデサルタンで治療開始。
Hb:13.5g/dL,破砕赤血球なし。
血液検査,尿検査上,二次性腎炎を示唆する所見なし。
赤血球:4,580,000/μL,ヘモグロビン:13.5g/dL,血小板:
120,000/μL,eGFR:55mL/min/1.73m2,尿蛋白:4+
中止18日後 ハプトグロビン:10mg/dL以下
中止20日後 一次性腎炎または本剤によるネフローゼ症候群を疑い,腎生
検を実施。
【光顕所見】
巣状分節性にメサンギウム領域の拡大,係蹄内の泡沫細胞浸
潤,内皮下からメサンギウム領域にMasson染色で赤紫する
沈着物を認めた。また,糸球体基底膜の二重化を多数認めた。
間質はやや浮腫状で,一部に繊維化と細胞浸潤を認め,所々
に尿細管上皮の空胞変性像を認めた。
【蛍光所見】
IgM,C4が糸球体基底膜に一致してfringe patternでの発光
を示していた。
【病理組織】
慢性増殖性糸球体腎炎様病変であり,TMA(血栓性微小血
管症)様病変と一致。
以上より,本剤による薬剤性ネフローゼ症候群と診断された。
赤血球:3,780,000/μL,ヘモグロビン:11.1g/dL,血小板:
99,000/μL,eGFR:66mL/min/1.73m2,尿蛋白:2+
中止22日後 ハプトグロビン61mg/dL
中止28日後 本剤の中止及びカンデサルタンの投与により蛋白尿が軽快し
退院。
赤血球:3,780,000/μL,ヘモグロビン:11.2g/dL,血小板:
171,000/μL,eGFR:75mL/min/1.73m2,尿蛋白:2+
中止70日後 薬剤性ネフローゼ症候群について完全寛解を得た。
赤血球:3,690,000/μL,ヘモグロビン:11.0g/dL,血小板:
225,000/μL,eGFR:76mL/min/1.73m2,尿蛋白:1+
医薬品・医療機器等安全性情報
No.395
-7-
2022年9月