よむ、つかう、まなぶ。
医薬品・医療機器等安全性情報395号 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/iyaku/index.html |
| 出典情報 | 医薬品・医療機器等安全性情報395号(9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2
重要な副作用等に関する情報
令和4年8月30日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について,改訂内容等ととも
に改訂の根拠となった症例の概要等に関する情報を紹介します。
1
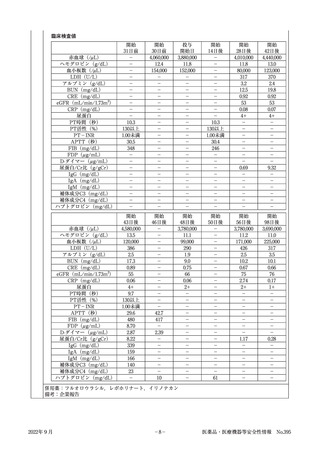
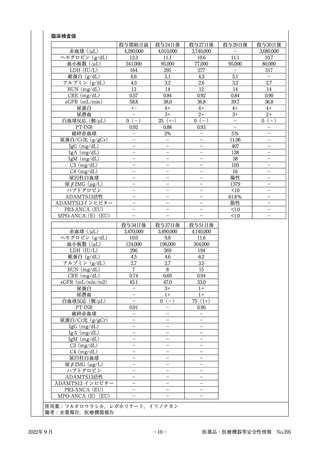
ラムシルマブ(遺伝子組換え)
販 売 名( 会 社 名 ) サイラムザ点滴静注液100mg,同点滴静注液500mg(日本イーライリリー株式会社)
薬 効 分 類 等 その他の腫瘍用薬
〇治癒切除不能な進行・再発の胃癌
効 能 又 は 効 果
〇治癒切除不能な進行・再発の結腸・直腸癌
〇切除不能な進行・再発の非小細胞肺癌
〇がん化学療法後に増悪した血清AFP値が400ng/mL以上の切除不能な肝細胞癌
《使用上の注意(下線部追加改訂部分)
》
(新記載要領)
11. 副作用
11.1 重大な副作用
(新設)
〈参
考〉
血栓性微小血管症
破砕赤血球を伴う貧血,血小板減少,腎機能障害等が認められた場合には,投与を中止し,
適切な処置を行うこと。
直近約3年度の副作用報告であって,因果関係が否定できないもの。
6例(うち死亡0例)
企業が推計した過去1年間の推定使用患者数:約77,400人
販売開始:平成27年6月
医薬品・医療機器等安全性情報
No.395
-5-
2022年9月
重要な副作用等に関する情報
令和4年8月30日に改訂を指導した医薬品の使用上の注意のうち重要な副作用等について,改訂内容等ととも
に改訂の根拠となった症例の概要等に関する情報を紹介します。
1
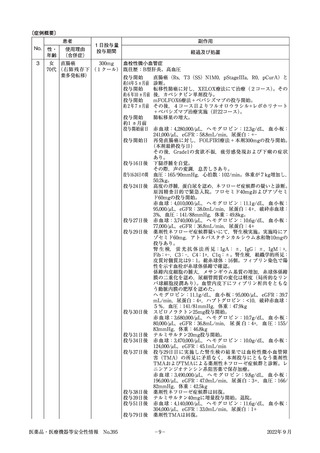
ラムシルマブ(遺伝子組換え)
販 売 名( 会 社 名 ) サイラムザ点滴静注液100mg,同点滴静注液500mg(日本イーライリリー株式会社)
薬 効 分 類 等 その他の腫瘍用薬
〇治癒切除不能な進行・再発の胃癌
効 能 又 は 効 果
〇治癒切除不能な進行・再発の結腸・直腸癌
〇切除不能な進行・再発の非小細胞肺癌
〇がん化学療法後に増悪した血清AFP値が400ng/mL以上の切除不能な肝細胞癌
《使用上の注意(下線部追加改訂部分)
》
(新記載要領)
11. 副作用
11.1 重大な副作用
(新設)
〈参
考〉
血栓性微小血管症
破砕赤血球を伴う貧血,血小板減少,腎機能障害等が認められた場合には,投与を中止し,
適切な処置を行うこと。
直近約3年度の副作用報告であって,因果関係が否定できないもの。
6例(うち死亡0例)
企業が推計した過去1年間の推定使用患者数:約77,400人
販売開始:平成27年6月
医薬品・医療機器等安全性情報
No.395
-5-
2022年9月