よむ、つかう、まなぶ。
【資料1-3】承認基準改正案 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28311.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第6回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
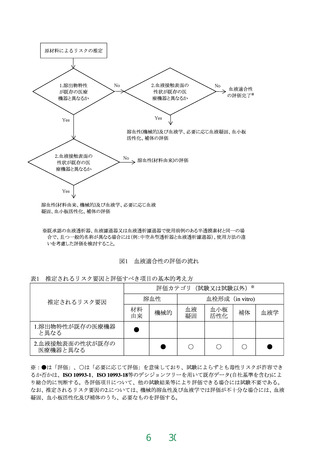
別紙1
血液濃縮器承認基準における技術基準
1 適用範囲
この基準は、体外循環を利用する心臓手術において、心筋保護液などにより希釈された血液成分
を水及び電解質の除去によって濃縮するために使用される血液濃縮器のうち、既存品と同等性を有
する血液濃縮器に適用する。
2 引用規格
この基準は下記の規格又は基準(以下「規格等」という。)を引用する。引用する規格等が下記
の規格等と同等以上の場合には、本邦又は外国の規格等を使用することができる。
・JIS T 3250:20132022, 血液透析器,血液透析ろ(濾)過器,血液ろ(濾)過器及び血液濃縮器
・JIS T 0993-1:2020, 医療機器の生物学的評価-第 1 部:リスクマネジメントプロセスにおける評価
及び試験
・JIS T 0993-7:2012, 医療機器の生物学的評価―第7部:エチレンオキサイド滅菌残留物
・薬生機審発 0106 第 1 号:令和 2 年 1 月 6 日, 医療機器の製造販売承認申請等に必要な生物学的安
全性評価の基本的考え方についての改正について
・薬食監麻発第 0330001 号:平成 17 年 3 月 30 日, 薬事法及び採血及び供血あつせん業取締法の
一部を改正する法律の施行に伴う医薬品、医療機器等の製造管理及び品質管理(GMP/QMS)
に係る省令及び告示の制定及び改廃について第 4 章第 4 滅菌バリデーション基準(以下「滅
菌バリデーション基準」という。)薬食監麻発 0215 第 13 号:平成 29 年 2 月 15 日、滅菌バリデー
ション基準の改正について(以下、「滅菌バリデーション基準」という。)
3 定義
用語の定義は、JIS T 3250 の 3「用語及び定義」によるを参照する。但し、当該規格の血液透析器、
血液透析濾過器及び血液濾過器のみに関係する定義は除外する。
4 材質並びに形状及び構造
本品は容器、中空糸膜又は平膜、血液ポート、血液ポート用キャップ、濾液ポート用キャップ、ポ
ッティング材等からなる。
5 物理的又は化学的要求事項
5.1 全体的な構造
JIS T 3250 の 4.4.1「全体的な構造」に適合すること。
5.2 血液側の構造
JIS T 3250 の 4.4.2「血液側の構造」に適合すること。
5.3 血液濃縮器の血液側及びろ液側接続部分
JIS T 3250 の 4.4.6「血液濃縮器の血液側及びろ液側接続部分」に適合すること。ロック付きコネク
タのうち形状が 4.4.3 に適合する場合は 15N 以下の引張力で外れてはならないものとする。
6 生物学的要求事項
10 / 30
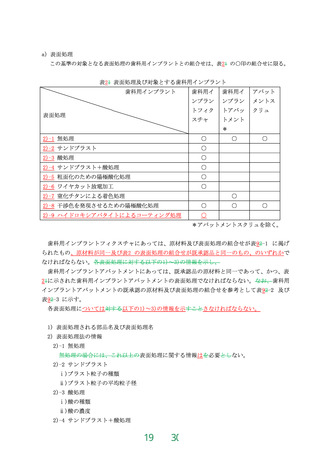
血液濃縮器承認基準における技術基準
1 適用範囲
この基準は、体外循環を利用する心臓手術において、心筋保護液などにより希釈された血液成分
を水及び電解質の除去によって濃縮するために使用される血液濃縮器のうち、既存品と同等性を有
する血液濃縮器に適用する。
2 引用規格
この基準は下記の規格又は基準(以下「規格等」という。)を引用する。引用する規格等が下記
の規格等と同等以上の場合には、本邦又は外国の規格等を使用することができる。
・JIS T 3250:20132022, 血液透析器,血液透析ろ(濾)過器,血液ろ(濾)過器及び血液濃縮器
・JIS T 0993-1:2020, 医療機器の生物学的評価-第 1 部:リスクマネジメントプロセスにおける評価
及び試験
・JIS T 0993-7:2012, 医療機器の生物学的評価―第7部:エチレンオキサイド滅菌残留物
・薬生機審発 0106 第 1 号:令和 2 年 1 月 6 日, 医療機器の製造販売承認申請等に必要な生物学的安
全性評価の基本的考え方についての改正について
・薬食監麻発第 0330001 号:平成 17 年 3 月 30 日, 薬事法及び採血及び供血あつせん業取締法の
一部を改正する法律の施行に伴う医薬品、医療機器等の製造管理及び品質管理(GMP/QMS)
に係る省令及び告示の制定及び改廃について第 4 章第 4 滅菌バリデーション基準(以下「滅
菌バリデーション基準」という。)薬食監麻発 0215 第 13 号:平成 29 年 2 月 15 日、滅菌バリデー
ション基準の改正について(以下、「滅菌バリデーション基準」という。)
3 定義
用語の定義は、JIS T 3250 の 3「用語及び定義」によるを参照する。但し、当該規格の血液透析器、
血液透析濾過器及び血液濾過器のみに関係する定義は除外する。
4 材質並びに形状及び構造
本品は容器、中空糸膜又は平膜、血液ポート、血液ポート用キャップ、濾液ポート用キャップ、ポ
ッティング材等からなる。
5 物理的又は化学的要求事項
5.1 全体的な構造
JIS T 3250 の 4.4.1「全体的な構造」に適合すること。
5.2 血液側の構造
JIS T 3250 の 4.4.2「血液側の構造」に適合すること。
5.3 血液濃縮器の血液側及びろ液側接続部分
JIS T 3250 の 4.4.6「血液濃縮器の血液側及びろ液側接続部分」に適合すること。ロック付きコネク
タのうち形状が 4.4.3 に適合する場合は 15N 以下の引張力で外れてはならないものとする。
6 生物学的要求事項
10 / 30