よむ、つかう、まなぶ。
資料4-1 オキサリプラチン (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00024.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第52回 8/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
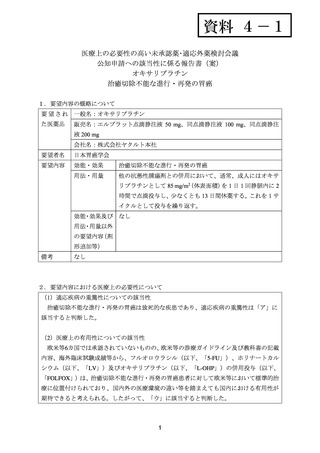
[90%CI]は1.12[0.81, 1.55]、p=0.56(有意水準:0.05(片側)、log-rank検定)であった。
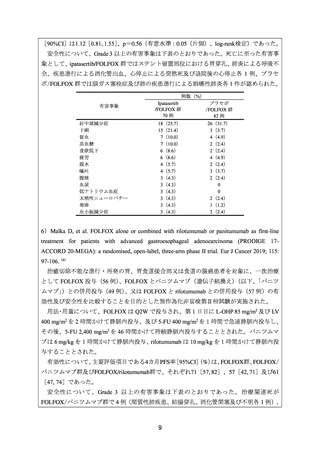
安全性について、Grade 3 以上の有害事象は下表のとおりであった。死亡に至った有害事
象として、ipatasertib/FOLFOX 群ではステント留置部位における胃穿孔、肺炎による呼吸不
全、疾患進行による消化管出血、心停止による突然死及び退院後の心停止各 1 例、プラセ
ボ/FOLFOX 群では脳ガス塞栓症及び肺の疾患進行による誤嚥性肺炎各 1 件が認められた。
有害事象
好中球減少症
下痢
貧血
高血糖
食欲低下
疲労
脱水
嘔吐
腹痛
血尿
低ナトリウム血症
末梢性ニューロパチー
発疹
血小板減少症
例数(%)
Ipatasertib
プラセボ
/FOLFOX 群
/FOLFOX 群
70 例
82 例
18(25.7)
15(21.4)
7(10.0)
7(10.0)
6(8.6)
6(8.6)
4(5.7)
4(5.7)
3(4.3)
3(4.3)
3(4.3)
3(4.3)
3(4.3)
3(4.3)
26(31.7)
3(3.7)
4(4.9)
2(2.4)
2(2.4)
4(4.9)
2(2.4)
3(3.7)
2(2.4)
0
0
2(2.4)
1(1.2)
2(2.4)
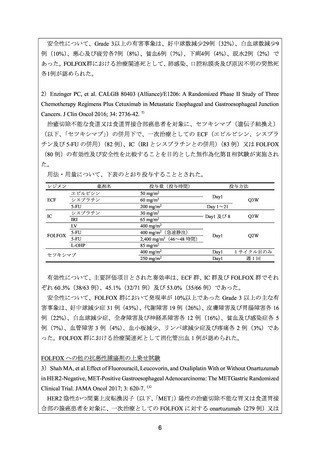
6)Malka D, et al. FOLFOX alone or combined with rilotumumab or panitumumab as first-line
treatment for patients with advanced gastroesophageal adenocarcinoma (PRODIGE 17ACCORD 20-MEGA): a randomised, open-label, three-arm phase II trial. Eur J Cancer 2019; 115:
97-106. 16)
治癒切除不能な進行・再発の胃、胃食道接合部又は食道の腺癌患者を対象に、一次治療
として FOLFOX 投与(56 例)
、FOLFOX とパニツムマブ(遺伝子組換え)
(以下、
「パニツ
ムマブ」)との併用投与(49 例)、又は FOLFOX と rilotumumab との併用投与(57 例)の有
効性及び安全性を比較することを目的とした無作為化非盲検第Ⅱ相試験が実施された。
用法・用量について、FOLFOX は Q2W で投与され、第 1 日目に L-OHP 85 mg/m2 及び LV
400 mg/m2 を 2 時間かけて静脈内投与、及び 5-FU 400 mg/m2 を 1 時間で急速静脈内投与し、
その後、5-FU 2,400 mg/m2 を 46 時間かけて持続静脈内投与することとされた。パニツムマ
ブは 6 mg/kg を 1 時間かけて静脈内投与、rilotumumab は 10 mg/kg を 1 時間かけて静脈内投
与することとされた。
有効性について、主要評価項目である4カ月PFS率[95%CI]
(%)は、FOLFOX群、FOLFOX/
パニツムマブ群及びFOLFOX/rilotumumab群で、それぞれ71[57, 82]、57[42, 71]及び61
[47, 74]であった。
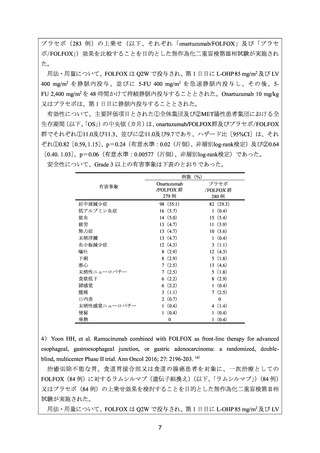
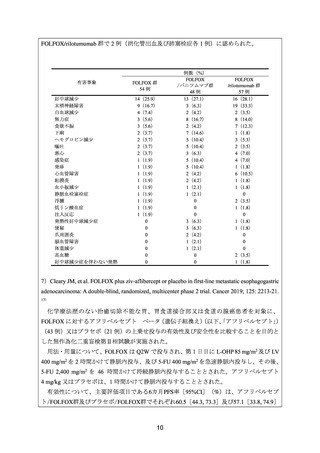
安全性について、Grade 3 以上の有害事象は下表のとおりであった。治療関連死が
FOLFOX/パニツムマブ群で 4 例(間質性肺疾患、結腸穿孔、消化管閉塞及び不明各 1 例)、
9
安全性について、Grade 3 以上の有害事象は下表のとおりであった。死亡に至った有害事
象として、ipatasertib/FOLFOX 群ではステント留置部位における胃穿孔、肺炎による呼吸不
全、疾患進行による消化管出血、心停止による突然死及び退院後の心停止各 1 例、プラセ
ボ/FOLFOX 群では脳ガス塞栓症及び肺の疾患進行による誤嚥性肺炎各 1 件が認められた。
有害事象
好中球減少症
下痢
貧血
高血糖
食欲低下
疲労
脱水
嘔吐
腹痛
血尿
低ナトリウム血症
末梢性ニューロパチー
発疹
血小板減少症
例数(%)
Ipatasertib
プラセボ
/FOLFOX 群
/FOLFOX 群
70 例
82 例
18(25.7)
15(21.4)
7(10.0)
7(10.0)
6(8.6)
6(8.6)
4(5.7)
4(5.7)
3(4.3)
3(4.3)
3(4.3)
3(4.3)
3(4.3)
3(4.3)
26(31.7)
3(3.7)
4(4.9)
2(2.4)
2(2.4)
4(4.9)
2(2.4)
3(3.7)
2(2.4)
0
0
2(2.4)
1(1.2)
2(2.4)
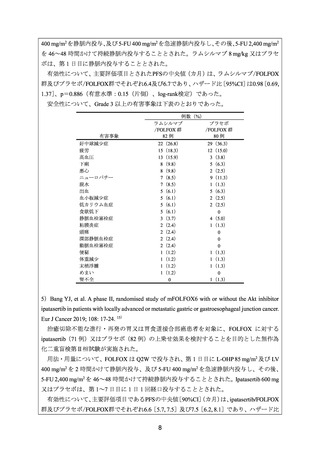
6)Malka D, et al. FOLFOX alone or combined with rilotumumab or panitumumab as first-line
treatment for patients with advanced gastroesophageal adenocarcinoma (PRODIGE 17ACCORD 20-MEGA): a randomised, open-label, three-arm phase II trial. Eur J Cancer 2019; 115:
97-106. 16)
治癒切除不能な進行・再発の胃、胃食道接合部又は食道の腺癌患者を対象に、一次治療
として FOLFOX 投与(56 例)
、FOLFOX とパニツムマブ(遺伝子組換え)
(以下、
「パニツ
ムマブ」)との併用投与(49 例)、又は FOLFOX と rilotumumab との併用投与(57 例)の有
効性及び安全性を比較することを目的とした無作為化非盲検第Ⅱ相試験が実施された。
用法・用量について、FOLFOX は Q2W で投与され、第 1 日目に L-OHP 85 mg/m2 及び LV
400 mg/m2 を 2 時間かけて静脈内投与、及び 5-FU 400 mg/m2 を 1 時間で急速静脈内投与し、
その後、5-FU 2,400 mg/m2 を 46 時間かけて持続静脈内投与することとされた。パニツムマ
ブは 6 mg/kg を 1 時間かけて静脈内投与、rilotumumab は 10 mg/kg を 1 時間かけて静脈内投
与することとされた。
有効性について、主要評価項目である4カ月PFS率[95%CI]
(%)は、FOLFOX群、FOLFOX/
パニツムマブ群及びFOLFOX/rilotumumab群で、それぞれ71[57, 82]、57[42, 71]及び61
[47, 74]であった。
安全性について、Grade 3 以上の有害事象は下表のとおりであった。治療関連死が
FOLFOX/パニツムマブ群で 4 例(間質性肺疾患、結腸穿孔、消化管閉塞及び不明各 1 例)、
9