よむ、つかう、まなぶ。
資料1 遺伝子治療等臨床研究に関する指針の一部改正に係る検討の方向性 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27062.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会 遺伝子治療等臨床研究における個人情報の取扱いの在り方に関する専門委員会(第9回 7/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
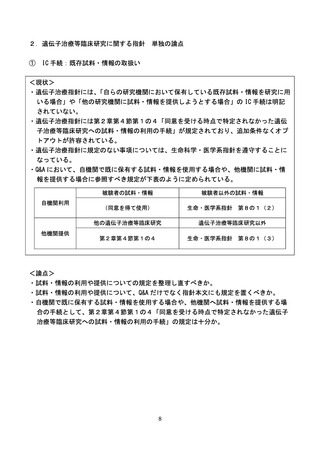
(2)外国の研究機関に提供する場合の留意点
<現状>
・現行指針においては、旧ゲノム指針に記載されていた、海外の研究機関との共同研究を実
施する場合の細則(下記)のうち、1.(3)について規定されていない。
【参考】旧ゲノム指針 第2の6
<海外の研究機関との共同研究を実施する際の細則>
1.第2の6(2)ア(イ)に規定する事項は次に掲げるものとする。
(1)インフォームド・コンセントを得られること(※)
(2)提供者の個人情報の保護について適切な措置が講じられること
(3)研究計画の科学的・倫理的妥当性について、相手国により承認されること、又は相手国が定
める法令、指針等に基づいて相手国の機関内の倫理審査委員会若しくはこれに準ずる組織によ
り承認され、相手国の研究を行う機関の長により許可されること
2.(略)
※学術例外・公衆衛生例外等あり
<論点>
・日本国外における研究が実施される場合、情報漏えいが発生した場合のリスクを懸念する
声があるため、日本国内の研究機関との共同研究でない場合も含めて、日本国外の研究機
関に対して試料・情報を提供する際の留意点について追加で規定すべき点はないか。
※生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(6月2日)での
委員からの意見
・ゲノム指針の細則として書かれていたような事項について、指針本文に規定すべきか、例
示としてガイダンスに記載すべきか、十分に検討すべきではないか。
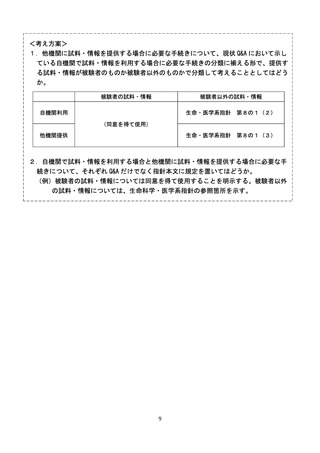
【生命科学・医学系指針見直しの方向性案】
・外国の研究機関に提供する場合の留意点については、下記の点を含め、ガイダンスにおい
て例示を示す。
○旧ゲノム指針に記載されていた、海外の研究機関との共同研究を実施する場合の細則
のうち、1.
(3)に規定されていた事項
○試料の取扱いに関する情報についても研究対象者等に提供しなければならないこと。
→
遺伝子治療指針でも同様に、外国の研究機関に提供する場合の留意点について Q&A に
示すこととしてよいか。
7
<現状>
・現行指針においては、旧ゲノム指針に記載されていた、海外の研究機関との共同研究を実
施する場合の細則(下記)のうち、1.(3)について規定されていない。
【参考】旧ゲノム指針 第2の6
<海外の研究機関との共同研究を実施する際の細則>
1.第2の6(2)ア(イ)に規定する事項は次に掲げるものとする。
(1)インフォームド・コンセントを得られること(※)
(2)提供者の個人情報の保護について適切な措置が講じられること
(3)研究計画の科学的・倫理的妥当性について、相手国により承認されること、又は相手国が定
める法令、指針等に基づいて相手国の機関内の倫理審査委員会若しくはこれに準ずる組織によ
り承認され、相手国の研究を行う機関の長により許可されること
2.(略)
※学術例外・公衆衛生例外等あり
<論点>
・日本国外における研究が実施される場合、情報漏えいが発生した場合のリスクを懸念する
声があるため、日本国内の研究機関との共同研究でない場合も含めて、日本国外の研究機
関に対して試料・情報を提供する際の留意点について追加で規定すべき点はないか。
※生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(6月2日)での
委員からの意見
・ゲノム指針の細則として書かれていたような事項について、指針本文に規定すべきか、例
示としてガイダンスに記載すべきか、十分に検討すべきではないか。
【生命科学・医学系指針見直しの方向性案】
・外国の研究機関に提供する場合の留意点については、下記の点を含め、ガイダンスにおい
て例示を示す。
○旧ゲノム指針に記載されていた、海外の研究機関との共同研究を実施する場合の細則
のうち、1.
(3)に規定されていた事項
○試料の取扱いに関する情報についても研究対象者等に提供しなければならないこと。
→
遺伝子治療指針でも同様に、外国の研究機関に提供する場合の留意点について Q&A に
示すこととしてよいか。
7