よむ、つかう、まなぶ。
資料1 遺伝子治療等臨床研究に関する指針の一部改正に係る検討の方向性 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27062.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会 遺伝子治療等臨床研究における個人情報の取扱いの在り方に関する専門委員会(第9回 7/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
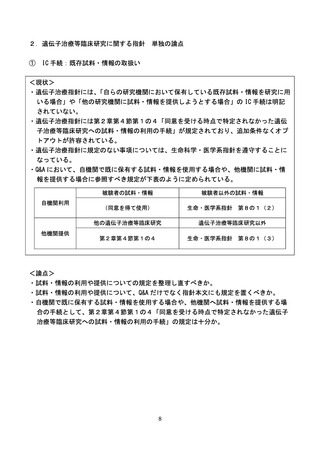
【参考】第2章第4節第1
4
インフォームド・コンセントを受ける手続等
同意を受ける時点で特定されなかった遺伝子治療等臨床研究への試料・情報の利用の手続
研究責任者等は、被験者から同意を受ける時点で想定される試料・情報の利用目的等について可能な
限り説明した場合であって、その後、利用目的等が新たに特定されたときは、研究計画書を作成又は変
更した上で、新たに特定された利用目的についての情報を被験者等に通知し、又は被験者等が容易に知
り得る状態に置き、新たに遺伝子治療等臨床研究が実施されることについて、被験者等が同意を撤回で
きる機会を保障しなければならない。
【参考】「遺伝子治療等臨床研究に関する指針」の一部改正に関する Q&A
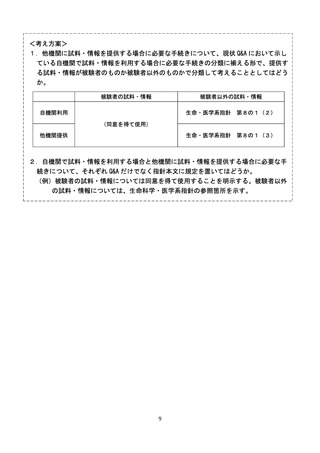
Q7 自機関で既に保有する試料・情報の使用についての手続きはどのようにすべきか。
A 自機関で研究計画時に既に保有する、被験者の試料・情報の使用については、被験者の同意を得て
使用してください。
一方で、自機関で保有する、被験者以外の試料・情報を使用する場合は、指針上規定がないため、
「人を対象とする生命科学・医学系研究に関する倫理指針(以下「生命科学・医学系指針」とい
う。
)」第1章第3の1「ただし、他の指針の適用範囲に含まれる研究にあっては、当該指針に規定さ
れていない事項についてはこの指針の規定により行うものとする。
」に則り、同指針第4章第8の1
(2)の規定を遵守してください。
Q10 遺伝子治療等臨床研究で得られた試料・情報を他機関に提供する場合の手続きはどのようにすべ
きか。
A 当該研究で得られた試料・情報を他の遺伝子治療等臨床研究で利用する場合の手続きについては、
指針第2章第4節第1の4に規定のとおりです。ただし、個人情報保護法の例外規定が適用されない
場合は、オプトアウトによる提供はできませんのでご留意ください。
遺伝子治療等臨床研究以外の研究に提供する場合は、指針上規定がないため、
「生命科学・医学系
指針」第4章第8の1(3)の規定を遵守して下さい。
【参考】生命科学・医学系指針 第3 適用範囲
1
適用される研究
この指針は、我が国の研究者等により実施され、又は日本国内において実施される人を対象とする生
命科学・医学系研究を対象とする。ただし、他の指針の適用範囲に含まれる研究にあっては、当該指針
に規定されていない事項についてはこの指針の規定により行うものとする。
(略)
10
4
インフォームド・コンセントを受ける手続等
同意を受ける時点で特定されなかった遺伝子治療等臨床研究への試料・情報の利用の手続
研究責任者等は、被験者から同意を受ける時点で想定される試料・情報の利用目的等について可能な
限り説明した場合であって、その後、利用目的等が新たに特定されたときは、研究計画書を作成又は変
更した上で、新たに特定された利用目的についての情報を被験者等に通知し、又は被験者等が容易に知
り得る状態に置き、新たに遺伝子治療等臨床研究が実施されることについて、被験者等が同意を撤回で
きる機会を保障しなければならない。
【参考】「遺伝子治療等臨床研究に関する指針」の一部改正に関する Q&A
Q7 自機関で既に保有する試料・情報の使用についての手続きはどのようにすべきか。
A 自機関で研究計画時に既に保有する、被験者の試料・情報の使用については、被験者の同意を得て
使用してください。
一方で、自機関で保有する、被験者以外の試料・情報を使用する場合は、指針上規定がないため、
「人を対象とする生命科学・医学系研究に関する倫理指針(以下「生命科学・医学系指針」とい
う。
)」第1章第3の1「ただし、他の指針の適用範囲に含まれる研究にあっては、当該指針に規定さ
れていない事項についてはこの指針の規定により行うものとする。
」に則り、同指針第4章第8の1
(2)の規定を遵守してください。
Q10 遺伝子治療等臨床研究で得られた試料・情報を他機関に提供する場合の手続きはどのようにすべ
きか。
A 当該研究で得られた試料・情報を他の遺伝子治療等臨床研究で利用する場合の手続きについては、
指針第2章第4節第1の4に規定のとおりです。ただし、個人情報保護法の例外規定が適用されない
場合は、オプトアウトによる提供はできませんのでご留意ください。
遺伝子治療等臨床研究以外の研究に提供する場合は、指針上規定がないため、
「生命科学・医学系
指針」第4章第8の1(3)の規定を遵守して下さい。
【参考】生命科学・医学系指針 第3 適用範囲
1
適用される研究
この指針は、我が国の研究者等により実施され、又は日本国内において実施される人を対象とする生
命科学・医学系研究を対象とする。ただし、他の指針の適用範囲に含まれる研究にあっては、当該指針
に規定されていない事項についてはこの指針の規定により行うものとする。
(略)
10