よむ、つかう、まなぶ。
総-3-2医療用医薬品の薬価基準収載等に係る取扱いについて(案) (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_70414.html |
| 出典情報 | 中央社会保険医療協議会 総会(第647回 2/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
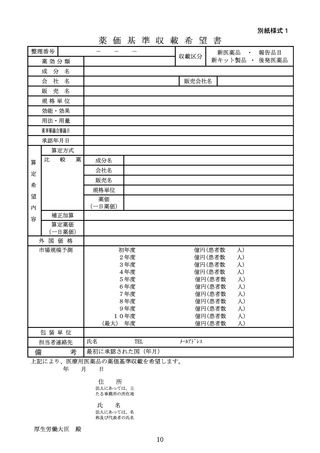
別紙様式5
再算定候補品目要件該当性検討資料
(再算定要件該当性資料)
区分
1 市場拡大再算定、2 効能変化再算定、3 用法用量変化再算定
名
称
等
一般的名称
販売名
規格単位
成分及び分量又は本質
用法及び用量
効能又は効果
承認日、承認番号
再審査期間
一部変更承認日
再審査期間
これまでの再算定
1)市場拡大再算定の場合は薬価収載時又は直近の市場拡大再算定時点での基準年間販
売額を添付
令和7年 11 月以降に小児、希少疾病、先駆的若しくは特定用途に係る効能・効果又は用法・用量が追加
された場合又は令和6年4月以降に迅速導入により効能・効果又は用法・用量が追加された場合は効能・
効果又は用法・用量の新旧対照表を添付。
また、令和6年4月以降に薬価収載されたものであって、市販後に、診療ガイドラインの記載から、薬
価収載時の主たる効能又は効果に係る対象疾病に対する国内の標準的治療法となった場合は当該診療ガイ
ドライン等根拠となる関連資料を添付。市販後に集積された調査成績により真の臨床的有用性が直接的に
検証されている場合は当該調査成績の概要等根拠となる関連資料を添付。
また、「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」(令和
6年1月 12 日付け医薬薬審発 0112 第3号厚生労働省医薬局医薬品審査管理課長通知)に基づき独立行政
法人医薬品医療機器総合機構の確認を受けた小児用医薬品の開発計画に基づき遅滞なく開発が進められて
いる品目である場合は根拠となる資料を添付。
2)効能変化再算定又は用法用量変化再算定の場合は効能・効果又は用法・用量の新旧
対照表を添付
上記により再算定候補品目の要件該当性に関する検討資料を提出します。
年
月
日
住所
法人にあっては、主
たる事務所の所在地
氏名
法人にあっては、名
称及び代表者の氏名
厚生労働大臣
殿
14
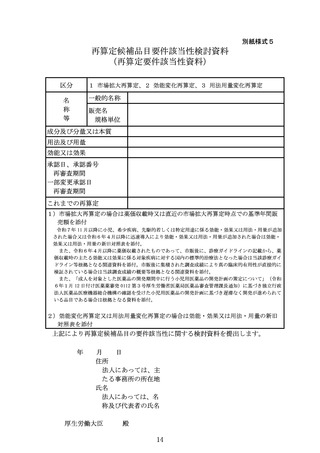
再算定候補品目要件該当性検討資料
(再算定要件該当性資料)
区分
1 市場拡大再算定、2 効能変化再算定、3 用法用量変化再算定
名
称
等
一般的名称
販売名
規格単位
成分及び分量又は本質
用法及び用量
効能又は効果
承認日、承認番号
再審査期間
一部変更承認日
再審査期間
これまでの再算定
1)市場拡大再算定の場合は薬価収載時又は直近の市場拡大再算定時点での基準年間販
売額を添付
令和7年 11 月以降に小児、希少疾病、先駆的若しくは特定用途に係る効能・効果又は用法・用量が追加
された場合又は令和6年4月以降に迅速導入により効能・効果又は用法・用量が追加された場合は効能・
効果又は用法・用量の新旧対照表を添付。
また、令和6年4月以降に薬価収載されたものであって、市販後に、診療ガイドラインの記載から、薬
価収載時の主たる効能又は効果に係る対象疾病に対する国内の標準的治療法となった場合は当該診療ガイ
ドライン等根拠となる関連資料を添付。市販後に集積された調査成績により真の臨床的有用性が直接的に
検証されている場合は当該調査成績の概要等根拠となる関連資料を添付。
また、「成人を対象とした医薬品の開発期間中に行う小児用医薬品の開発計画の策定について」(令和
6年1月 12 日付け医薬薬審発 0112 第3号厚生労働省医薬局医薬品審査管理課長通知)に基づき独立行政
法人医薬品医療機器総合機構の確認を受けた小児用医薬品の開発計画に基づき遅滞なく開発が進められて
いる品目である場合は根拠となる資料を添付。
2)効能変化再算定又は用法用量変化再算定の場合は効能・効果又は用法・用量の新旧
対照表を添付
上記により再算定候補品目の要件該当性に関する検討資料を提出します。
年
月
日
住所
法人にあっては、主
たる事務所の所在地
氏名
法人にあっては、名
称及び代表者の氏名
厚生労働大臣
殿
14