よむ、つかう、まなぶ。
総-3参考8 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_67369.html |
| 出典情報 | 中央社会保険医療協議会 総会(第636回 12/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
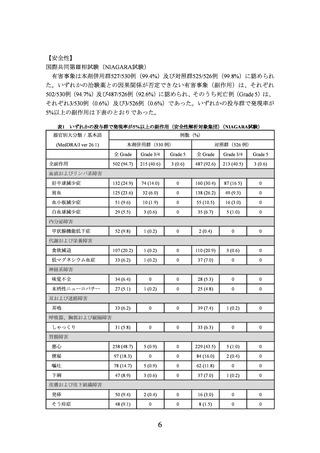
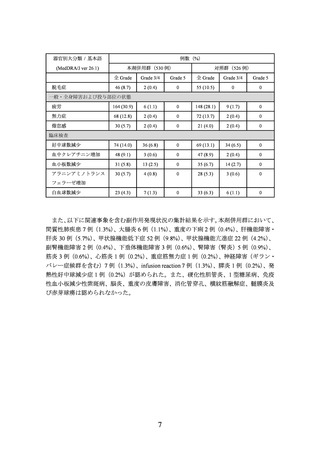
3.臨床成績
膀胱癌における術前・術後補助療法の承認時に評価を行った主な臨床試験の成績を示
す。
【有効性】
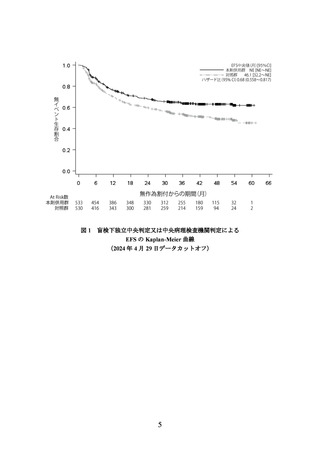
国際共同第Ⅲ相試験(NIAGARA 試験)
筋層浸潤性膀胱癌(MIBC)に対する全身化学療法歴又は免疫療法歴のない、根治的
膀胱全摘除術の適応となる臨床病期 T2-T4aN0M0 又は T2-T4aN1M0 の MIBC 患者*1
(WHO/ECOG Performance Status 0 又は 1)1,063 例(日本人 121 例を含む)を対象に、
術前補助療法として本剤*2 をゲムシタビン塩酸塩(以下、
「ゲムシタビン」
)+シスプラ
チン*3 と併用投与し、その後の術後補助療法として本剤*4 を単独投与した場合(本剤併
用群 533 例[日本人 62 例を含む]
)と、術前補助療法としてゲムシタビン+シスプラチ
ン*3 を併用投与した場合(対照群 530 例[日本人 59 例を含む]
)の有効性及び安全性を
検討した。
主要評価項目の一つである盲検下独立中央判定又は中央病理検査機関判定による無
イベント生存期間(以下、
「EFS」)
(中央値[95%信頼区間]
)(433 件のイベント)の 2
回目の中間解析の結果は、本剤併用群で NE*5[NE~NE]、対照群で 46.1[32.2~NE]
カ月であった(ハザード比[95%信頼区間]
:0.68[0.558~0.817]*6、p<0.0001[層別 logrank 検定、有意水準(両側)0.04123]
、2024 年 4 月 29 日データカットオフ)*7。
*1:臨床病期は American Joint Committee on Cancer 病期分類(第 8 版)に基づく。組織検査又は細胞診
で確認された膀胱(腎盂及び尿管を除く)の尿路上皮癌(組織型が尿路上皮癌及び尿路上皮癌の亜
型/サブタイプ)患者を対象とした。
*2:術前補助療法:3 週間を 1 サイクルとして、第 1 日目に本剤 1,500mg を 4 サイクル投与した。
*3:クレアチニンクリアランス 60mL/min 以上の患者には、3 週間を 1 サイクルとして、第 1 日目にゲ
ムシタビン 1,000mg/m2 とシスプラチン 70mg/m2、第 8 日目にゲムシタビン 1,000mg/m2 を 4 サイク
ル投与した。クレアチニンクリアランス 40mL/min 以上 60mL/min 未満の患者には、3 週間を 1 サ
イクルとして、第 1 及び 8 日目にゲムシタビン 1,000mg/m2 とシスプラチン 35mg/m2 を 4 サイクル
投与した。
*4:術後補助療法:4 週間を 1 サイクルとして、第 1 日目に本剤 1,500mg を最大 8 サイクル投与した。
*5:推定不能(以下、同様)
*6:有意水準に対応した 95.877%信頼区間は[0.554~0.824]
*7:EFS の 1 回目の中間解析後に改訂された治験実施計画書に基づく解析結果
4
膀胱癌における術前・術後補助療法の承認時に評価を行った主な臨床試験の成績を示
す。
【有効性】
国際共同第Ⅲ相試験(NIAGARA 試験)
筋層浸潤性膀胱癌(MIBC)に対する全身化学療法歴又は免疫療法歴のない、根治的
膀胱全摘除術の適応となる臨床病期 T2-T4aN0M0 又は T2-T4aN1M0 の MIBC 患者*1
(WHO/ECOG Performance Status 0 又は 1)1,063 例(日本人 121 例を含む)を対象に、
術前補助療法として本剤*2 をゲムシタビン塩酸塩(以下、
「ゲムシタビン」
)+シスプラ
チン*3 と併用投与し、その後の術後補助療法として本剤*4 を単独投与した場合(本剤併
用群 533 例[日本人 62 例を含む]
)と、術前補助療法としてゲムシタビン+シスプラチ
ン*3 を併用投与した場合(対照群 530 例[日本人 59 例を含む]
)の有効性及び安全性を
検討した。
主要評価項目の一つである盲検下独立中央判定又は中央病理検査機関判定による無
イベント生存期間(以下、
「EFS」)
(中央値[95%信頼区間]
)(433 件のイベント)の 2
回目の中間解析の結果は、本剤併用群で NE*5[NE~NE]、対照群で 46.1[32.2~NE]
カ月であった(ハザード比[95%信頼区間]
:0.68[0.558~0.817]*6、p<0.0001[層別 logrank 検定、有意水準(両側)0.04123]
、2024 年 4 月 29 日データカットオフ)*7。
*1:臨床病期は American Joint Committee on Cancer 病期分類(第 8 版)に基づく。組織検査又は細胞診
で確認された膀胱(腎盂及び尿管を除く)の尿路上皮癌(組織型が尿路上皮癌及び尿路上皮癌の亜
型/サブタイプ)患者を対象とした。
*2:術前補助療法:3 週間を 1 サイクルとして、第 1 日目に本剤 1,500mg を 4 サイクル投与した。
*3:クレアチニンクリアランス 60mL/min 以上の患者には、3 週間を 1 サイクルとして、第 1 日目にゲ
ムシタビン 1,000mg/m2 とシスプラチン 70mg/m2、第 8 日目にゲムシタビン 1,000mg/m2 を 4 サイク
ル投与した。クレアチニンクリアランス 40mL/min 以上 60mL/min 未満の患者には、3 週間を 1 サ
イクルとして、第 1 及び 8 日目にゲムシタビン 1,000mg/m2 とシスプラチン 35mg/m2 を 4 サイクル
投与した。
*4:術後補助療法:4 週間を 1 サイクルとして、第 1 日目に本剤 1,500mg を最大 8 サイクル投与した。
*5:推定不能(以下、同様)
*6:有意水準に対応した 95.877%信頼区間は[0.554~0.824]
*7:EFS の 1 回目の中間解析後に改訂された治験実施計画書に基づく解析結果
4