よむ、つかう、まなぶ。
総-3参考6 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_67369.html |
| 出典情報 | 中央社会保険医療協議会 総会(第636回 12/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
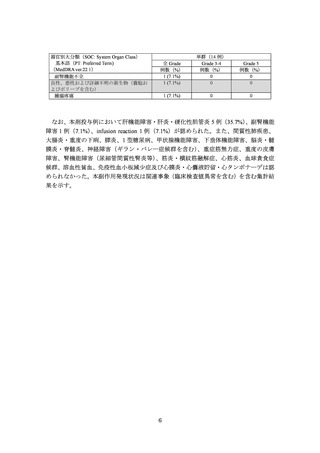
3.臨床成績
再発又は難治性の節外性 NK/T 細胞リンパ腫・鼻型の承認時に評価を行った主な臨床
試験の成績を示す。
【有効性】
国内第Ⅱ相臨床試験(ATTACK 試験)
12 歳以上の再発又は難治性の節外性 NK/T 細胞リンパ腫・鼻型患者*114 例を対象に、
本剤の有効性及び安全性を検討する第Ⅱ相試験を実施した。18 歳以上の患者には本剤
1,200 mg を 3 週間間隔(
(以下、
「Q3W」という。
)で、12 歳以上 18 歳未満の患者には本
剤 15 mg/kg(最大 1,200 mg)を Q3W で静脈内投与した。
本試験に登録された 14 例のうち、中央判定によりベースライン時の測定可能病変あ
りと判断されなかった 1 例を除く 13 例を有効性の解析対象とした。主要評価項目であ
る Lugano 基準に基づく中央判定による奏効率[95%信頼区間]
(%)は、53.8(
[25.1, 80.8]
(7/13 例)であった。
*1(
:節外性 NK/T 細胞リンパ腫・鼻型に対する 1 レジメン以上の治療歴があり、かつ、SMILE 療法(
(デ
キサメタゾン、メトトレキサート、イホスファミド、L-アスパラギナーゼ及びエトポシドの併用)
による治療歴がある又は適応とならない患者が対象とされた。なお、次の①~⑧のいずれかに該
当した場合に、SMILE 療法に適応とならない患者と判断された:①ECOG Performance Status 2、
②70 歳以上、③組入れ前に実施された化学療法により、支持療法として週 1 回以上の輸血を必要
とする状態、④末梢血リンパ球数 500/mm3 未満、⑤造血幹細胞移植歴がある、⑥虚血性変化、心
房細動若しくは治療を要する心室性不整脈が 1 つ以上認められる、⑦左室駆出率 50%未満、又は
⑧SMILE 療法以外のがん薬物療法に対して不耐容である。
4
再発又は難治性の節外性 NK/T 細胞リンパ腫・鼻型の承認時に評価を行った主な臨床
試験の成績を示す。
【有効性】
国内第Ⅱ相臨床試験(ATTACK 試験)
12 歳以上の再発又は難治性の節外性 NK/T 細胞リンパ腫・鼻型患者*114 例を対象に、
本剤の有効性及び安全性を検討する第Ⅱ相試験を実施した。18 歳以上の患者には本剤
1,200 mg を 3 週間間隔(
(以下、
「Q3W」という。
)で、12 歳以上 18 歳未満の患者には本
剤 15 mg/kg(最大 1,200 mg)を Q3W で静脈内投与した。
本試験に登録された 14 例のうち、中央判定によりベースライン時の測定可能病変あ
りと判断されなかった 1 例を除く 13 例を有効性の解析対象とした。主要評価項目であ
る Lugano 基準に基づく中央判定による奏効率[95%信頼区間]
(%)は、53.8(
[25.1, 80.8]
(7/13 例)であった。
*1(
:節外性 NK/T 細胞リンパ腫・鼻型に対する 1 レジメン以上の治療歴があり、かつ、SMILE 療法(
(デ
キサメタゾン、メトトレキサート、イホスファミド、L-アスパラギナーゼ及びエトポシドの併用)
による治療歴がある又は適応とならない患者が対象とされた。なお、次の①~⑧のいずれかに該
当した場合に、SMILE 療法に適応とならない患者と判断された:①ECOG Performance Status 2、
②70 歳以上、③組入れ前に実施された化学療法により、支持療法として週 1 回以上の輸血を必要
とする状態、④末梢血リンパ球数 500/mm3 未満、⑤造血幹細胞移植歴がある、⑥虚血性変化、心
房細動若しくは治療を要する心室性不整脈が 1 つ以上認められる、⑦左室駆出率 50%未満、又は
⑧SMILE 療法以外のがん薬物療法に対して不耐容である。
4