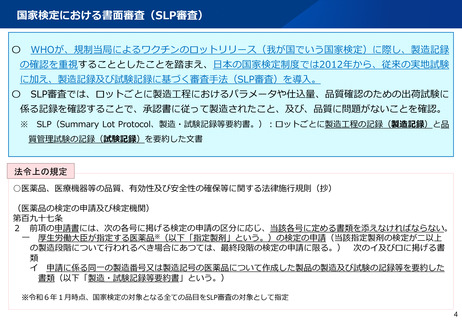
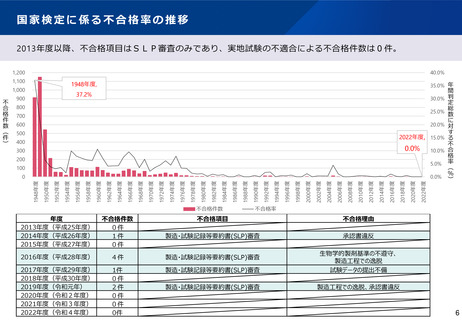
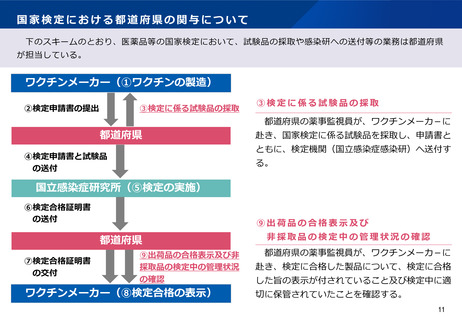
よむ、つかう、まなぶ。
資料1-3国家検定実施方法の見直しについて (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37830.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和5年度第1回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
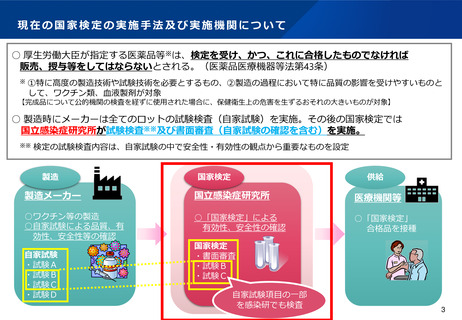
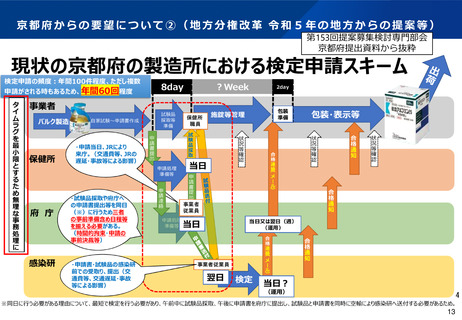
現在の国家検定の実施手法及び実施機関について
○ 厚生労働大臣が指定する医薬品等※は、検定を受け、かつ、これに合格したものでなければ
販売、授与等をしてはならないとされる。(医薬品医療機器等法第43条)
※ ①特に高度の製造技術や試験技術を必要とするもの、②製造の過程において特に品質の影響を受けやすいものと
して、ワクチン類、血液製剤が対象
【完成品について公的機関の検査を経ずに使用された場合に、保健衛生上の危害を生ずるおそれの大きいものが対象】
○ 製造時にメーカーは全てのロットの試験検査(自家試験)を実施。その後の国家検定では
国立感染症研究所が試験検査※※及び書面審査(自家試験の確認を含む)を実施。
※※ 検定の試験検査内容は、自家試験の中で安全性・有効性の観点から重要なものを設定
製造
国家検定
供給
製造メーカー
国立感染症研究所
医療機関等
○ワクチン等の製造
○自家試験による品質、有
効性、安全性等の確認
○「国家検定」による
有効性、安全性の確認
○「国家検定」
合格品を接種
自家試験
・試験A
・試験B
・試験C
・試験D
国家検定
・書面審査
・試験B
・試験C
自家試験項目の一部
を感染研でも検査
3
○ 厚生労働大臣が指定する医薬品等※は、検定を受け、かつ、これに合格したものでなければ
販売、授与等をしてはならないとされる。(医薬品医療機器等法第43条)
※ ①特に高度の製造技術や試験技術を必要とするもの、②製造の過程において特に品質の影響を受けやすいものと
して、ワクチン類、血液製剤が対象
【完成品について公的機関の検査を経ずに使用された場合に、保健衛生上の危害を生ずるおそれの大きいものが対象】
○ 製造時にメーカーは全てのロットの試験検査(自家試験)を実施。その後の国家検定では
国立感染症研究所が試験検査※※及び書面審査(自家試験の確認を含む)を実施。
※※ 検定の試験検査内容は、自家試験の中で安全性・有効性の観点から重要なものを設定
製造
国家検定
供給
製造メーカー
国立感染症研究所
医療機関等
○ワクチン等の製造
○自家試験による品質、有
効性、安全性等の確認
○「国家検定」による
有効性、安全性の確認
○「国家検定」
合格品を接種
自家試験
・試験A
・試験B
・試験C
・試験D
国家検定
・書面審査
・試験B
・試験C
自家試験項目の一部
を感染研でも検査
3