よむ、つかう、まなぶ。
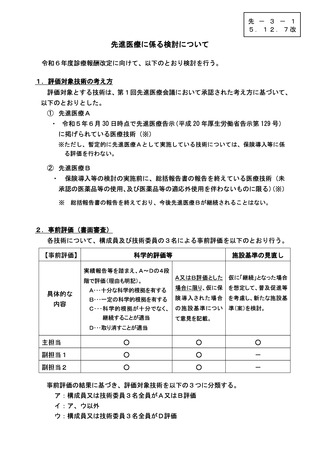
技-2-2○ 医療技術の評価(案)について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00012.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第2回 1/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
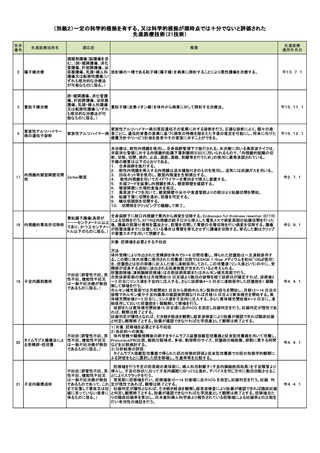
【選択基準】
・対象:本研究の対象者は、
1) 1回以上顕微授精を実施しても移植可能胚が得られず、または胚移植しても妊娠に至らなかった
症例で、次の採卵で顕微授精を予定する方
2) 本研究の概要や計画を説明し、同意を得らえた後、研究対象とする。
【除外基準】
不妊症(卵管性不妊、男
・高度乏精子症の男性不妊患者
性不妊、機能性不妊又
(原精液での総運動性精子数が10万未満総運動性精子数=液量(ml)×精子濃度(1mlあたり)×精
は一般不妊治療が無効
子運動率(%)で算出)
であるものに限る。)
・TESE/TESA/PESA の対象となる男性不妊症患者
・凍結融解精子を使用する患者
・非同意および上記の対象条件を満たさない方
・生殖補助医療治療計画書を作成時の女性年齢が43歳以上のカップル
・その他、研究責任医師又は研究分担医師等が本研究を安全に実施するのに不適当と判断した症
例
令5.3.1
手術的には他の開腹手術に比べて出血量が多く、また侵襲性の高い子宮頸癌(但し、FIGOによる臨
床進行期ⅠB以上、ⅡB以下の扁平上皮癌、あるいは臨床進行期ⅠA2以上、ⅡB以下の腺癌に限
子宮頸がん(FIGOによる る、転移は認めない)の症例を対象に、ロボット支援広汎子宮全摘出術を施行し、従来の開腹術との
臨床進行期分類がⅠB 間で有効性、安全性を比較する。(内視鏡下の子宮広範全摘術は2015年から先進医療Aにて試験
期以上及びⅡB期以下 開始となったところである)。全身麻酔・二酸化炭素気腹下に腹腔鏡を用いて広汎子宮全摘出術を
の扁平上皮がん又は
行う。portの位置、本数、種類、小開腹創の位置は規定せず、「腹腔内の検索」はすべて内視鏡下で
内視鏡下手術用ロボット
FIGOによる臨床進行期 行い、「リンパ節郭清および主幹動脈の処理」、「併施手術」は原則すべてロボット支援下にて行う。
B② を用いた腹腔鏡下広汎
分類がⅠA2期以上及び 術中腫瘍の進展により他臓器合併切除が必要となった場合は、ロボット支援下続行か開腹手術に
子宮全摘術
ⅡB期以下の腺がんで 移行するかは手術担当責任医の判断に委ねられ、合併切除を行った場合は切除臓器をCRFに記載
あって、リンパ節転移及 する。プロトコル治療完了後は新病変が確認されるまでは後治療を行わない。ただし、術後再発リス
び腹腔内臓器に転移して ク因子を有する症例に関しては、術後再発リスク評価(子宮頸癌の術後再発リスク分類:子宮頸癌
いないものに限る。)
治療ガイドライン2011年度版:日本婦人科腫瘍学会)にしたがって後治療を考慮する。また切除断端
陽性が確認された場合又は子宮癌以外の疾患であった場合の後治療は規定しない。
予定症例数は100例、予定試験期間は6.5年(登録期間:1.5年,追跡期間:5年)である。
平28.4.1
進行再発固形がん(食道
がん遺伝子パネル検査は 2019 年6月から保険診療で実施できるようになったが、その適応は標準
がん、胃がん、大腸が
治療がない、もしくは終了した(終了見込み含む)症例に限られている。一方で、Precision Medicine
ん、膵がん、胆道がん、
のコンセプトからは、初回治療の段階から症例毎にがん細胞の遺伝子異常に合わせた治療を選択
肺がん、乳がん、卵巣が
マルチプレックス遺伝子
したほうが、より効果的である可能性が考えられてきた。
B④
ん若しくは子宮がん又は
パネル検査
本研究では、腫瘍組織検体から作成されたホルマリン固定パラフィン包埋(FFPE)検体を米国
悪性黒色腫であって、化
Foundation medicine 社に提出し解析を行い、解析結果のレポートを得る。レポートをもとにエキス
学療法又は放射線治療
パートパネルにおいて、Actionable/Druggable な遺伝子異常の割合等を求め、初回治療法選択にお
を行っていないものに限
ける遺伝子プロファイリング検査の臨床的有用性を検証する。
る。)
令3.5.1
腫瘍、顎骨骨髄炎、外傷
等の疾患による広範囲
の顎骨又は歯槽骨欠損
(上顎にあっては連続し
顎顔面外傷、顎骨腫瘍摘出術、嚢胞摘出術等による顎骨欠損を有する患者を対象とし、MSCsを培
た三分の一顎程度以上
養・分化誘導した骨髄由来間葉系細胞による骨造成を行い、その有効性及び安全性を検討する。以
の顎骨欠損又は上顎洞
下の手順で臨床試験を実施する。
若しくは鼻腔への交通が
1. 骨髄由来間葉系細胞の調製(間葉系細胞群のみ)
骨髄由来間葉系細胞に 認められる顎骨欠損に
B⑤
2. 多血小板血漿(PRP)の調製
よる顎骨再生療法
限り、下顎にあっては連
3. 試験製剤(対照群:PRP+ヒトトロンビン+塩化カルシウム+β-TCP、間葉系細胞群:骨髄由来間葉
続した三分の一顎程度
系細胞+PRP+ヒトトロンビン+塩化カルシウム+β-TCP)の作製
以上の歯槽骨欠損又は
4. 試験製剤を骨欠損又は骨移植部位に移植
下顎区域切除以上の顎
5. 移植後の評価項目を評価する。
骨欠損に限り、歯槽骨欠
損にあっては歯周疾患及
び加齢による骨吸収を除
く。)
平28.1.1
バージャー病(従来の治
薬物治療や運動療法、血行再建術などの現在保険収載されている標準治療に難治性の閉塞性血
療法に抵抗性を有するも
自家骨髄単核球移植に
栓血管炎(バージャー病)に伴う重症虚血肢を対象とし、組織皮膚灌流圧(SPP値)や組織酸素分圧
B⑦
のであって、フォンタン分
よる下肢血管再生治療
(TcpO2)の改善や潰瘍径の縮小等の重症虚血肢のおける組織治癒評価項目を測定し、骨髄単核球
類III度又はIV度のものに
細胞を用いた血管再生療法の有効性を評価する。
限る。)
平29.10.1
30
膜構造を用いた生理学
的精子選択術
※:告示番号23・24・27・28・29については、ロードマップにおいて、薬事承認を目指している技術。
※:B④の技術については、旧告示番号51番の技術を指す。
10
・対象:本研究の対象者は、
1) 1回以上顕微授精を実施しても移植可能胚が得られず、または胚移植しても妊娠に至らなかった
症例で、次の採卵で顕微授精を予定する方
2) 本研究の概要や計画を説明し、同意を得らえた後、研究対象とする。
【除外基準】
不妊症(卵管性不妊、男
・高度乏精子症の男性不妊患者
性不妊、機能性不妊又
(原精液での総運動性精子数が10万未満総運動性精子数=液量(ml)×精子濃度(1mlあたり)×精
は一般不妊治療が無効
子運動率(%)で算出)
であるものに限る。)
・TESE/TESA/PESA の対象となる男性不妊症患者
・凍結融解精子を使用する患者
・非同意および上記の対象条件を満たさない方
・生殖補助医療治療計画書を作成時の女性年齢が43歳以上のカップル
・その他、研究責任医師又は研究分担医師等が本研究を安全に実施するのに不適当と判断した症
例
令5.3.1
手術的には他の開腹手術に比べて出血量が多く、また侵襲性の高い子宮頸癌(但し、FIGOによる臨
床進行期ⅠB以上、ⅡB以下の扁平上皮癌、あるいは臨床進行期ⅠA2以上、ⅡB以下の腺癌に限
子宮頸がん(FIGOによる る、転移は認めない)の症例を対象に、ロボット支援広汎子宮全摘出術を施行し、従来の開腹術との
臨床進行期分類がⅠB 間で有効性、安全性を比較する。(内視鏡下の子宮広範全摘術は2015年から先進医療Aにて試験
期以上及びⅡB期以下 開始となったところである)。全身麻酔・二酸化炭素気腹下に腹腔鏡を用いて広汎子宮全摘出術を
の扁平上皮がん又は
行う。portの位置、本数、種類、小開腹創の位置は規定せず、「腹腔内の検索」はすべて内視鏡下で
内視鏡下手術用ロボット
FIGOによる臨床進行期 行い、「リンパ節郭清および主幹動脈の処理」、「併施手術」は原則すべてロボット支援下にて行う。
B② を用いた腹腔鏡下広汎
分類がⅠA2期以上及び 術中腫瘍の進展により他臓器合併切除が必要となった場合は、ロボット支援下続行か開腹手術に
子宮全摘術
ⅡB期以下の腺がんで 移行するかは手術担当責任医の判断に委ねられ、合併切除を行った場合は切除臓器をCRFに記載
あって、リンパ節転移及 する。プロトコル治療完了後は新病変が確認されるまでは後治療を行わない。ただし、術後再発リス
び腹腔内臓器に転移して ク因子を有する症例に関しては、術後再発リスク評価(子宮頸癌の術後再発リスク分類:子宮頸癌
いないものに限る。)
治療ガイドライン2011年度版:日本婦人科腫瘍学会)にしたがって後治療を考慮する。また切除断端
陽性が確認された場合又は子宮癌以外の疾患であった場合の後治療は規定しない。
予定症例数は100例、予定試験期間は6.5年(登録期間:1.5年,追跡期間:5年)である。
平28.4.1
進行再発固形がん(食道
がん遺伝子パネル検査は 2019 年6月から保険診療で実施できるようになったが、その適応は標準
がん、胃がん、大腸が
治療がない、もしくは終了した(終了見込み含む)症例に限られている。一方で、Precision Medicine
ん、膵がん、胆道がん、
のコンセプトからは、初回治療の段階から症例毎にがん細胞の遺伝子異常に合わせた治療を選択
肺がん、乳がん、卵巣が
マルチプレックス遺伝子
したほうが、より効果的である可能性が考えられてきた。
B④
ん若しくは子宮がん又は
パネル検査
本研究では、腫瘍組織検体から作成されたホルマリン固定パラフィン包埋(FFPE)検体を米国
悪性黒色腫であって、化
Foundation medicine 社に提出し解析を行い、解析結果のレポートを得る。レポートをもとにエキス
学療法又は放射線治療
パートパネルにおいて、Actionable/Druggable な遺伝子異常の割合等を求め、初回治療法選択にお
を行っていないものに限
ける遺伝子プロファイリング検査の臨床的有用性を検証する。
る。)
令3.5.1
腫瘍、顎骨骨髄炎、外傷
等の疾患による広範囲
の顎骨又は歯槽骨欠損
(上顎にあっては連続し
顎顔面外傷、顎骨腫瘍摘出術、嚢胞摘出術等による顎骨欠損を有する患者を対象とし、MSCsを培
た三分の一顎程度以上
養・分化誘導した骨髄由来間葉系細胞による骨造成を行い、その有効性及び安全性を検討する。以
の顎骨欠損又は上顎洞
下の手順で臨床試験を実施する。
若しくは鼻腔への交通が
1. 骨髄由来間葉系細胞の調製(間葉系細胞群のみ)
骨髄由来間葉系細胞に 認められる顎骨欠損に
B⑤
2. 多血小板血漿(PRP)の調製
よる顎骨再生療法
限り、下顎にあっては連
3. 試験製剤(対照群:PRP+ヒトトロンビン+塩化カルシウム+β-TCP、間葉系細胞群:骨髄由来間葉
続した三分の一顎程度
系細胞+PRP+ヒトトロンビン+塩化カルシウム+β-TCP)の作製
以上の歯槽骨欠損又は
4. 試験製剤を骨欠損又は骨移植部位に移植
下顎区域切除以上の顎
5. 移植後の評価項目を評価する。
骨欠損に限り、歯槽骨欠
損にあっては歯周疾患及
び加齢による骨吸収を除
く。)
平28.1.1
バージャー病(従来の治
薬物治療や運動療法、血行再建術などの現在保険収載されている標準治療に難治性の閉塞性血
療法に抵抗性を有するも
自家骨髄単核球移植に
栓血管炎(バージャー病)に伴う重症虚血肢を対象とし、組織皮膚灌流圧(SPP値)や組織酸素分圧
B⑦
のであって、フォンタン分
よる下肢血管再生治療
(TcpO2)の改善や潰瘍径の縮小等の重症虚血肢のおける組織治癒評価項目を測定し、骨髄単核球
類III度又はIV度のものに
細胞を用いた血管再生療法の有効性を評価する。
限る。)
平29.10.1
30
膜構造を用いた生理学
的精子選択術
※:告示番号23・24・27・28・29については、ロードマップにおいて、薬事承認を目指している技術。
※:B④の技術については、旧告示番号51番の技術を指す。
10