よむ、つかう、まなぶ。
総ー5○長期収載品(その2)について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00228.html |
| 出典情報 | 中央社会保険医療協議会 総会(第569回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
後発医薬品の承認審査
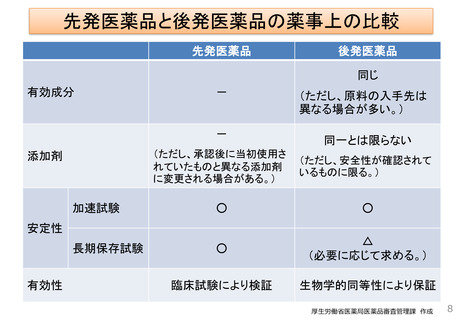
• 先発医薬品と品質・有効性・安全性において同等であるかを、後発医薬品企業の作成した
申請時添付資料に基づき審査する。
► 規格及び試験方法
♦ 3ロットについて3回の繰り返し測定の実測値
♦ 試験法のバリデーション(※)結果
➣有効成分の含量、不純物管理等が
先発医薬品と同等
※試験法のバリデーションとは、試験法の特異性、検出限界等を考慮し、用いる試験法が適切なものであることを確認すること。
► 安定性
♦ 3ロットについて、加速試験、品目により長期保存試験等の結果
➣安定性について先発医薬品と同等
► 生物学的同等性
♦ 「後発医薬品の生物学的同等性試験ガイドライン」に則り両者を比較
➣治療学的に先発医薬品と同等
※色、形、味、添加物が先発医薬品と同一であることは必ずしも求めていない。
両者で添加物が異なるにしても、生物学的同等性試験によって、有効性・安全性が同等であることを担保している。
※添加物については、安全性が確認されているもののみ認めている。
• 剤形による製剤の特性又は機能等の品質を規定すべきものについては、規格及び試験
方法の設定に際し、日本薬局方の通則、製剤総則、一般試験法、標準品及び試薬・試
液等を原則準用し、適合していることを確認する。
厚生労働省医薬局医薬品審査管理課 作成
7
• 先発医薬品と品質・有効性・安全性において同等であるかを、後発医薬品企業の作成した
申請時添付資料に基づき審査する。
► 規格及び試験方法
♦ 3ロットについて3回の繰り返し測定の実測値
♦ 試験法のバリデーション(※)結果
➣有効成分の含量、不純物管理等が
先発医薬品と同等
※試験法のバリデーションとは、試験法の特異性、検出限界等を考慮し、用いる試験法が適切なものであることを確認すること。
► 安定性
♦ 3ロットについて、加速試験、品目により長期保存試験等の結果
➣安定性について先発医薬品と同等
► 生物学的同等性
♦ 「後発医薬品の生物学的同等性試験ガイドライン」に則り両者を比較
➣治療学的に先発医薬品と同等
※色、形、味、添加物が先発医薬品と同一であることは必ずしも求めていない。
両者で添加物が異なるにしても、生物学的同等性試験によって、有効性・安全性が同等であることを担保している。
※添加物については、安全性が確認されているもののみ認めている。
• 剤形による製剤の特性又は機能等の品質を規定すべきものについては、規格及び試験
方法の設定に際し、日本薬局方の通則、製剤総則、一般試験法、標準品及び試薬・試
液等を原則準用し、適合していることを確認する。
厚生労働省医薬局医薬品審査管理課 作成
7