よむ、つかう、まなぶ。
○ 医療機器業界からの意見聴取について 材-2 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212455_00039.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第125回 11/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
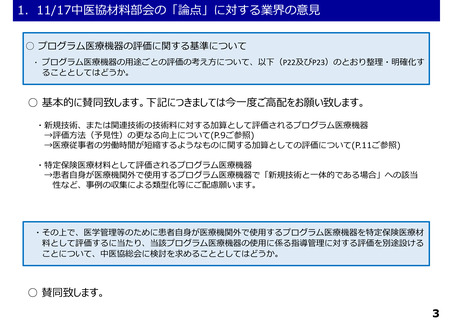
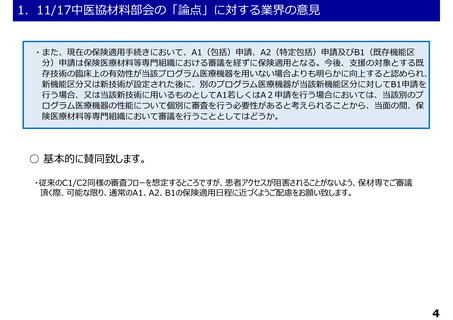
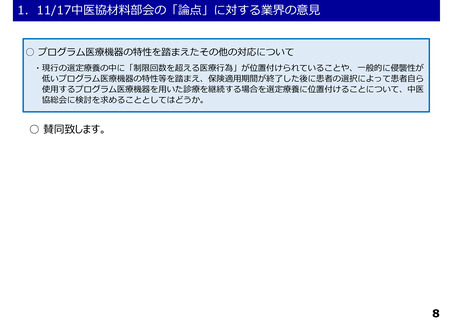
1.11/17中医協材料部会の「論点」に対する業界の意見
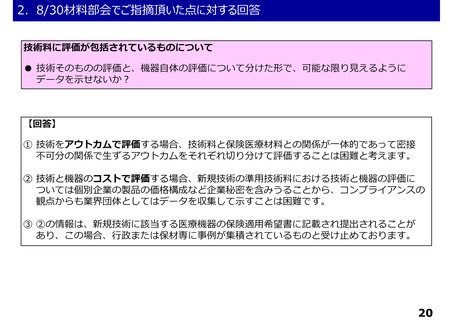
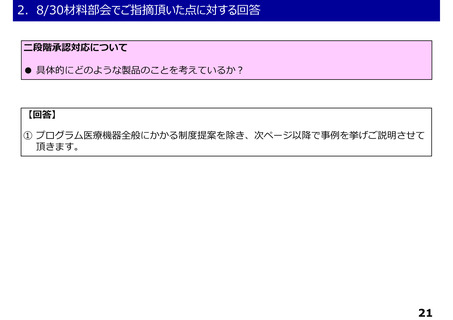
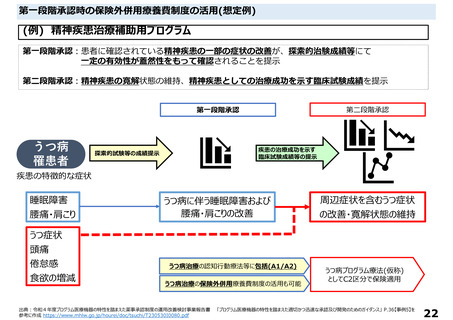
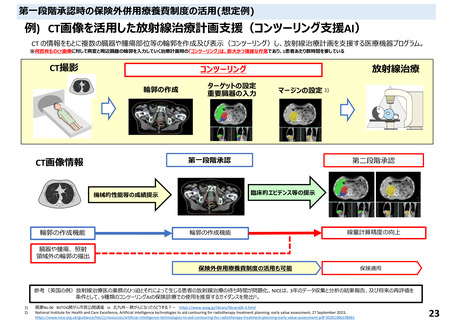
○薬事承認における二段階承認の考え方に基づく第1段階承認を取得したプログラム医療機器
について
・薬事承認における二段階承認の考え方に基づく第1段階承認を取得したプログラム医療機器について、
第1段階承認取得時点で想定される有効性に関するエビデンスでは、これまでに特定保険医療材料や技
術料に対する加算として評価されている医療機器等と同等に評価することは困難と考えられる。一方で、
有体物である医療機器よりも一般的に侵襲性が低いプログラム医療機器の特性を踏まえ、イノベーショ
ンの促進の観点から、第1段階承認を取得したプログラム医療機器を保険診療の中で活用可能となるよ
う、保険外併用療養費制度の見直しについて中医協総会に検討を求めることとしてはどうか。
○ 賛同致します。
・また、保険外併用療養費制度において当該プログラム医療機器の使用を行わない場合において、A1
(包括)又はA2(特定包括)区分で保険適用することは妨げられないことを明確化してはどうか。
○ 賛同致します。
6
○薬事承認における二段階承認の考え方に基づく第1段階承認を取得したプログラム医療機器
について
・薬事承認における二段階承認の考え方に基づく第1段階承認を取得したプログラム医療機器について、
第1段階承認取得時点で想定される有効性に関するエビデンスでは、これまでに特定保険医療材料や技
術料に対する加算として評価されている医療機器等と同等に評価することは困難と考えられる。一方で、
有体物である医療機器よりも一般的に侵襲性が低いプログラム医療機器の特性を踏まえ、イノベーショ
ンの促進の観点から、第1段階承認を取得したプログラム医療機器を保険診療の中で活用可能となるよ
う、保険外併用療養費制度の見直しについて中医協総会に検討を求めることとしてはどうか。
○ 賛同致します。
・また、保険外併用療養費制度において当該プログラム医療機器の使用を行わない場合において、A1
(包括)又はA2(特定包括)区分で保険適用することは妨げられないことを明確化してはどうか。
○ 賛同致します。
6