よむ、つかう、まなぶ。
資料1-1 医薬品等の使用上の注意の改訂について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
No.
一般名
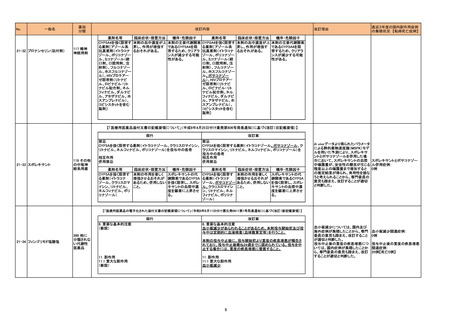
21-32 ブロナンセリン(貼付剤)
薬効
分類
117 精神
神経用剤
改訂内容
薬剤名等
CYP3A4を強く阻害す
る薬剤[アゾール系
抗真菌剤(イトラコナ
ゾール、ボリコナゾー
ル、ミコナゾール(経
口剤、口腔用剤、注
射剤)、フルコナゾー
ル、ホスフルコナゾー
ル)、HIVプロテアー
ゼ阻害剤(リトナビ
ル、ロピナビル・リト
ナビル配合剤、ネル
フィナビル、ダルナビ
ル、アタザナビル、ホ
スアンプレナビル)、
コビシスタットを含む
製剤]
改訂理由
臨床症状・措置方法
機序・危険因子
薬剤名等
本剤の血中濃度が上 本剤の主要代謝酵素 CYP3A4を強く阻害す
昇し、作用が増強す であるCYP3A4を阻 る薬剤[アゾール系
るおそれがある。
害するため、クリアラ 抗真菌剤(イトラコナ
ンスが減少する可能 ゾール、ボリコナゾー
性がある。
ル、ミコナゾール(経
口剤、口腔用剤、注
射剤)、フルコナゾー
ル、ホスフルコナゾー
ル、ポサコナゾー
ル)、HIVプロテアー
ゼ阻害剤(リトナビ
ル、ロピナビル・リト
ナビル配合剤、ネル
フィナビル、ダルナビ
ル、アタザナビル、ホ
スアンプレナビル)、
コビシスタットを含む
製剤]
直近3年度の国内副作用症例
の集積状況 【転帰死亡症例】
臨床症状・措置方法
機序・危険因子
本剤の血中濃度が上 本剤の主要代謝酵素
昇し、作用が増強す であるCYP3A4を阻
るおそれがある。
害するため、クリアラ
ンスが減少する可能
性がある。
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂(旧記載要領)】
現行
21-33 スボレキサント
119 その他
の中枢神
経系用薬
改訂案
禁忌
禁忌
CYP3Aを強く阻害する薬剤(イトラコナゾール、クラリスロマイシン、 CYP3Aを強く阻害する薬剤(イトラコナゾール、ポサコナゾール、ク
リトナビル、ネルフィナビル、ボリコナゾール)を投与中の患者
ラリスロマイシン、リトナビル、ネルフィナビル、ボリコナゾール)を
投与中の患者
相互作用
相互作用
併用禁忌
併用禁忌
薬剤名等
CYP3Aを強く阻害す
る薬剤(イトラコナ
ゾール、クラリスロマ
イシン、リトナビル、
ネルフィナビル、ボリ
コナゾール)
臨床症状・措置方法
本剤の作用を著しく
増強させるおそれが
あるため、併用しない
こと。
機序・危険因子
スボレキサントの代
謝酵素であるCYP3A
を強く阻害し、スボレ
キサントの血漿中濃
度を顕著に上昇させ
る。
薬剤名等
CYP3Aを強く阻害す
る薬剤(イトラコナ
ゾール、ポサコナゾー
ル、クラリスロマイシ
ン、リトナビル、ネル
フィナビル、ボリコナ
ゾール)
臨床症状・措置方法
本剤の作用を著しく
増強させるおそれが
あるため、併用しない
こと。
機序・危険因子
スボレキサントの代
謝酵素であるCYP3A
を強く阻害し、スボレ
キサントの血漿中濃
度を顕著に上昇させ
る。
In vivo データより得られたパラメータ
による静的薬物速度論(MSPK)モデ
ルを用いた予測により、スボレキサ
ントとポサコナゾールを併用した場
合において、スボレキサントの血漿 スボレキサントとポサコナゾー
中曝露量が、安全性の懸念が生じる ル併用症例:
程度以上の曝露量まで増加すると 0例
の推定結果が得られ、有用性を損な
うと考えられることから、専門委員の
意見も踏まえ、改訂することが適切
と判断した。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
8. 重要な基本的注意
(新設)
21-34 フィンゴリモド塩酸塩
399 他に
分類されな
い代謝性
医薬品
改訂案
8. 重要な基本的注意
血小板減少があらわれることがあるため、本剤投与開始前及び投
与中は定期的に血液検査(血球数算定等)を行うこと。
本剤の投与中止後に、投与開始前より重度の疾患増悪が報告さ
れており、投与中止後概ね24週までに認められている。投与を中
止する場合には、重度の疾患増悪に留意すること。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
血小板減少
5
血小板減少については、国内及び
海外症例が集積したことから、専門
委員の意見も踏まえ、改訂すること
が適切と判断した。
投与中止後の重度の疾患増悪につ
いては、国内症例が集積したことか
ら、専門委員の意見も踏まえ、改訂
することが適切と判断した。
血小板減少関連症例:
0例
投与中止後の重度の疾患増悪
関連症例:
20例【死亡0例】
一般名
21-32 ブロナンセリン(貼付剤)
薬効
分類
117 精神
神経用剤
改訂内容
薬剤名等
CYP3A4を強く阻害す
る薬剤[アゾール系
抗真菌剤(イトラコナ
ゾール、ボリコナゾー
ル、ミコナゾール(経
口剤、口腔用剤、注
射剤)、フルコナゾー
ル、ホスフルコナゾー
ル)、HIVプロテアー
ゼ阻害剤(リトナビ
ル、ロピナビル・リト
ナビル配合剤、ネル
フィナビル、ダルナビ
ル、アタザナビル、ホ
スアンプレナビル)、
コビシスタットを含む
製剤]
改訂理由
臨床症状・措置方法
機序・危険因子
薬剤名等
本剤の血中濃度が上 本剤の主要代謝酵素 CYP3A4を強く阻害す
昇し、作用が増強す であるCYP3A4を阻 る薬剤[アゾール系
るおそれがある。
害するため、クリアラ 抗真菌剤(イトラコナ
ンスが減少する可能 ゾール、ボリコナゾー
性がある。
ル、ミコナゾール(経
口剤、口腔用剤、注
射剤)、フルコナゾー
ル、ホスフルコナゾー
ル、ポサコナゾー
ル)、HIVプロテアー
ゼ阻害剤(リトナビ
ル、ロピナビル・リト
ナビル配合剤、ネル
フィナビル、ダルナビ
ル、アタザナビル、ホ
スアンプレナビル)、
コビシスタットを含む
製剤]
直近3年度の国内副作用症例
の集積状況 【転帰死亡症例】
臨床症状・措置方法
機序・危険因子
本剤の血中濃度が上 本剤の主要代謝酵素
昇し、作用が増強す であるCYP3A4を阻
るおそれがある。
害するため、クリアラ
ンスが減少する可能
性がある。
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂(旧記載要領)】
現行
21-33 スボレキサント
119 その他
の中枢神
経系用薬
改訂案
禁忌
禁忌
CYP3Aを強く阻害する薬剤(イトラコナゾール、クラリスロマイシン、 CYP3Aを強く阻害する薬剤(イトラコナゾール、ポサコナゾール、ク
リトナビル、ネルフィナビル、ボリコナゾール)を投与中の患者
ラリスロマイシン、リトナビル、ネルフィナビル、ボリコナゾール)を
投与中の患者
相互作用
相互作用
併用禁忌
併用禁忌
薬剤名等
CYP3Aを強く阻害す
る薬剤(イトラコナ
ゾール、クラリスロマ
イシン、リトナビル、
ネルフィナビル、ボリ
コナゾール)
臨床症状・措置方法
本剤の作用を著しく
増強させるおそれが
あるため、併用しない
こと。
機序・危険因子
スボレキサントの代
謝酵素であるCYP3A
を強く阻害し、スボレ
キサントの血漿中濃
度を顕著に上昇させ
る。
薬剤名等
CYP3Aを強く阻害す
る薬剤(イトラコナ
ゾール、ポサコナゾー
ル、クラリスロマイシ
ン、リトナビル、ネル
フィナビル、ボリコナ
ゾール)
臨床症状・措置方法
本剤の作用を著しく
増強させるおそれが
あるため、併用しない
こと。
機序・危険因子
スボレキサントの代
謝酵素であるCYP3A
を強く阻害し、スボレ
キサントの血漿中濃
度を顕著に上昇させ
る。
In vivo データより得られたパラメータ
による静的薬物速度論(MSPK)モデ
ルを用いた予測により、スボレキサ
ントとポサコナゾールを併用した場
合において、スボレキサントの血漿 スボレキサントとポサコナゾー
中曝露量が、安全性の懸念が生じる ル併用症例:
程度以上の曝露量まで増加すると 0例
の推定結果が得られ、有用性を損な
うと考えられることから、専門委員の
意見も踏まえ、改訂することが適切
と判断した。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
8. 重要な基本的注意
(新設)
21-34 フィンゴリモド塩酸塩
399 他に
分類されな
い代謝性
医薬品
改訂案
8. 重要な基本的注意
血小板減少があらわれることがあるため、本剤投与開始前及び投
与中は定期的に血液検査(血球数算定等)を行うこと。
本剤の投与中止後に、投与開始前より重度の疾患増悪が報告さ
れており、投与中止後概ね24週までに認められている。投与を中
止する場合には、重度の疾患増悪に留意すること。
11. 副作用
11.1 重大な副作用
(新設)
11. 副作用
11.1 重大な副作用
血小板減少
5
血小板減少については、国内及び
海外症例が集積したことから、専門
委員の意見も踏まえ、改訂すること
が適切と判断した。
投与中止後の重度の疾患増悪につ
いては、国内症例が集積したことか
ら、専門委員の意見も踏まえ、改訂
することが適切と判断した。
血小板減少関連症例:
0例
投与中止後の重度の疾患増悪
関連症例:
20例【死亡0例】