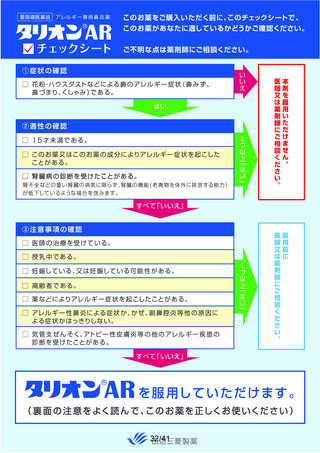
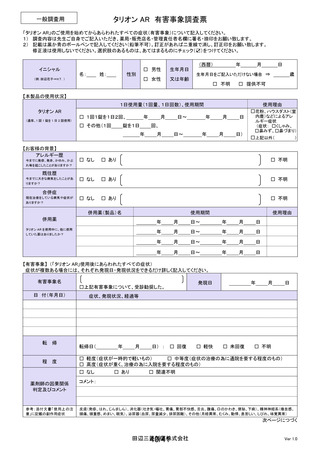
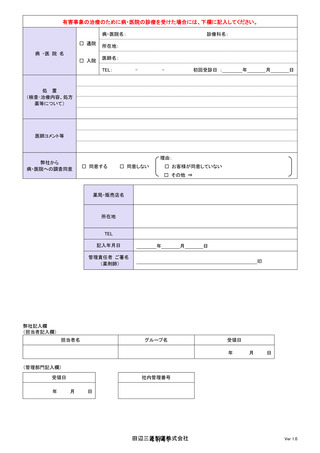
よむ、つかう、まなぶ。
資料1-2 ベポタスチンベシル酸塩のリスク評価について[4.5MB] (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35991.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第12回 10/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
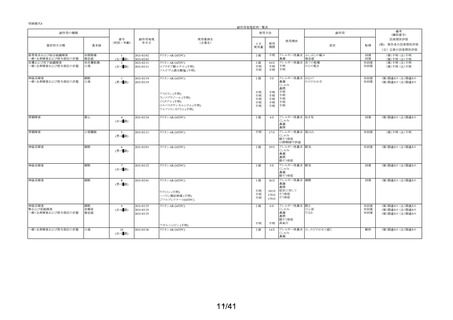
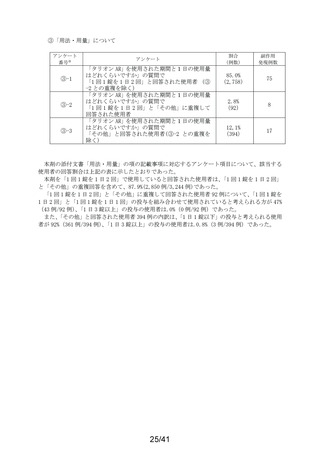
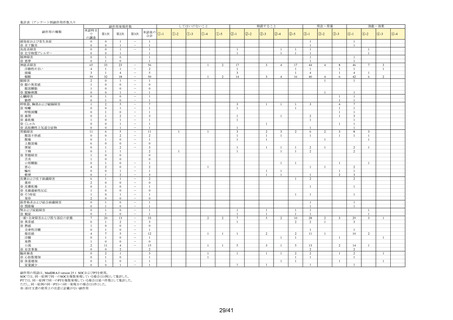
別紙様式2
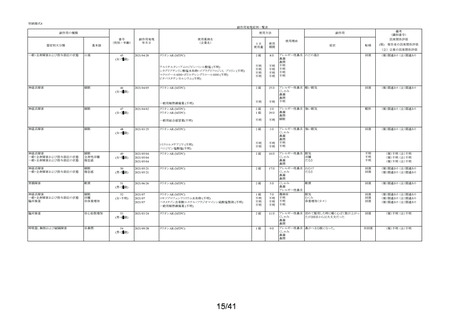
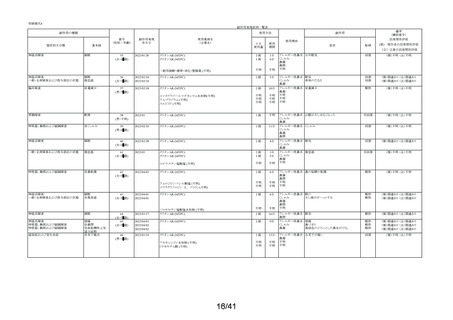
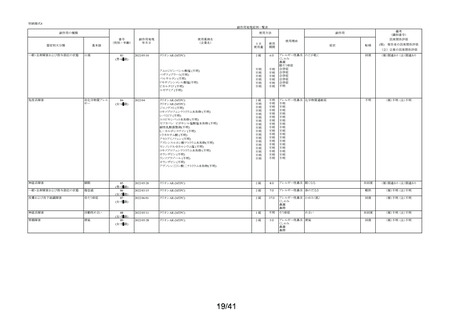
要指導医薬品製造販売後安全性調査報告書
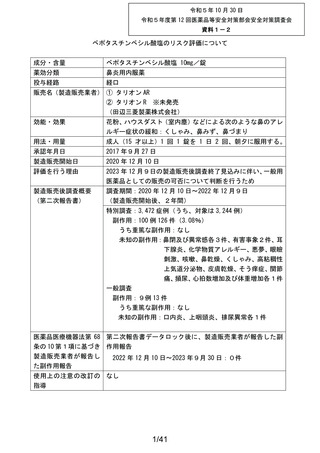
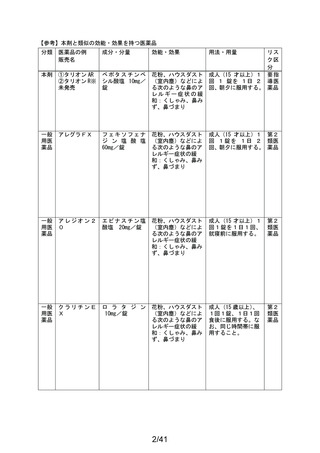
販売名
副作用頻度調査期間
調査施設数
出荷数量
承認番号・
年月日
①22900APX00322000
②22900APX00321000
①②2017年9月27日
有効成分名
ベポタスチンベシル酸塩
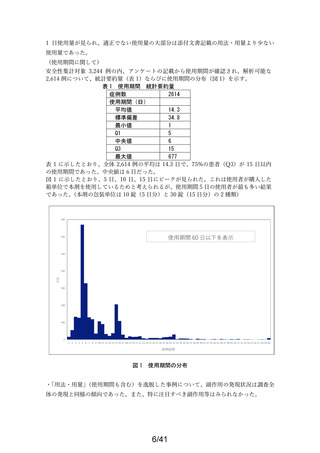
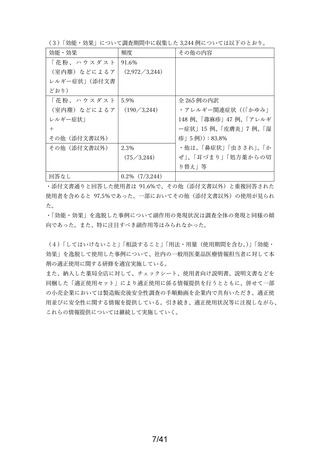
2021年12月10日~2022年12月9日
報告次数
第2次
22施設
調査症例数
1979症例
①タリオンAR
②タリオンR
①
錠
計
調査結果の概要
別紙(1)のとおり
副作用種類別発現状況
別紙様式3のとおり
副作用発現症例一覧表
別紙様式4及び様式5のとおり
別紙様式6は該当症例なし
調査結果に関する見解と
今後の安全対策
別紙(2)のとおり
備考
錠
承認区分 一般用医薬品(4)(要指導(一般用)新有効成分含有)
平成22年11月24日付薬食審査発1124第4号による開発要請に基づく申請を行い、
承認された。
医療用医薬品である「タリオン錠10㎎(承認番号:22000AMX01527000 平成20年3月
28日承認)」のスイッチOTC申請である。
タリオンAR 製造販売開始日:2020年12月10日
「タリオンR」は当該調査単位期間において製造販売していない。
今回の報告で、調査予定報告症例数(3,000例)に達した。
担当者: QV本部 グローバルPV部
(連絡先)TEL:
email:
上記により要指導医薬品製造販売後安全性調査の結果を報告します。
2023年2月6日
住所:大阪府大阪市中央区道修町三丁目2番10号
氏名:田辺三菱製薬株式会社
代表取締役 上野 裕明 印
独立行政法人医薬品医療機器総合機構理事長
藤原 康弘 殿
8/41
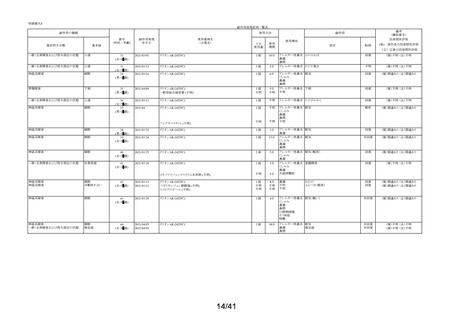
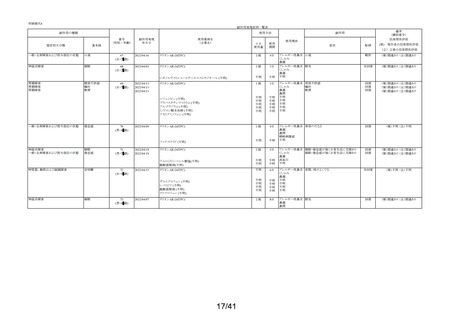
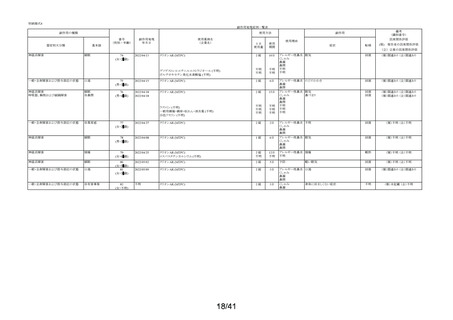
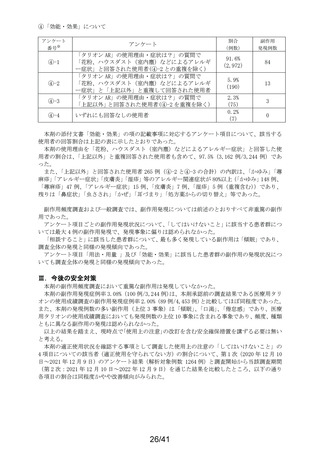
要指導医薬品製造販売後安全性調査報告書
販売名
副作用頻度調査期間
調査施設数
出荷数量
承認番号・
年月日
①22900APX00322000
②22900APX00321000
①②2017年9月27日
有効成分名
ベポタスチンベシル酸塩
2021年12月10日~2022年12月9日
報告次数
第2次
22施設
調査症例数
1979症例
①タリオンAR
②タリオンR
①
錠
計
調査結果の概要
別紙(1)のとおり
副作用種類別発現状況
別紙様式3のとおり
副作用発現症例一覧表
別紙様式4及び様式5のとおり
別紙様式6は該当症例なし
調査結果に関する見解と
今後の安全対策
別紙(2)のとおり
備考
錠
承認区分 一般用医薬品(4)(要指導(一般用)新有効成分含有)
平成22年11月24日付薬食審査発1124第4号による開発要請に基づく申請を行い、
承認された。
医療用医薬品である「タリオン錠10㎎(承認番号:22000AMX01527000 平成20年3月
28日承認)」のスイッチOTC申請である。
タリオンAR 製造販売開始日:2020年12月10日
「タリオンR」は当該調査単位期間において製造販売していない。
今回の報告で、調査予定報告症例数(3,000例)に達した。
担当者: QV本部 グローバルPV部
(連絡先)TEL:
email:
上記により要指導医薬品製造販売後安全性調査の結果を報告します。
2023年2月6日
住所:大阪府大阪市中央区道修町三丁目2番10号
氏名:田辺三菱製薬株式会社
代表取締役 上野 裕明 印
独立行政法人医薬品医療機器総合機構理事長
藤原 康弘 殿
8/41