よむ、つかう、まなぶ。
【資料1】医療機器の性能試験方法案について (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35596.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第3回 10/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
血管塞栓用デバイスの血栓塞栓性能に関する試験方法(案)
1
適用範囲
この規格は、治療デバイスである血管内塞栓促進補綴材の血栓塞栓性能に関する試験方法
を規定する。
2
用語及び定義
この規格で用いる主な用語及び定義は、次による。
2.1 血管内塞栓促進補綴材
動静脈に経皮的に留置し、血栓を形成させ、血流を遮断・改変させるために使用される治療
デバイスである。動静脈奇形、瘤、動静脈瘻等の異常血管、外傷性血管損傷による出血及び
腫瘍等に使用する。
2. 2 血栓塞栓化
塞栓対象とする血管の流れが静止した状態。例えば、平均流量 10 mL/min で臨床的な血栓
塞栓化とみなす。
2.3 血管モデル
評価対象とする血管を人工的に模擬したモデル
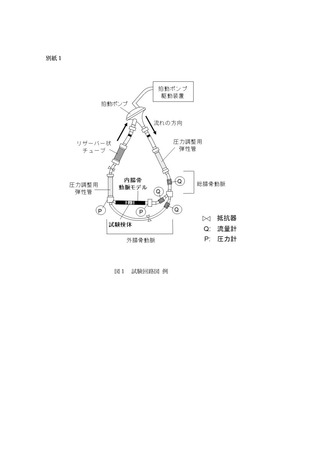
2.4 拍動ポンプ
試験回路内の流れを拍動流とするための装置
2.5 最終製品
滅菌を含む全ての製造工程を経た出荷可能な製品
3
血管塞栓用デバイスの血栓塞栓性能試験
3.1 一般
腸骨動脈等血流量の多い領域に対する血管塞栓術では、コイルに比べて逸脱リスクの少な
い血管塞栓用プラグが選択されることがあり、血栓塞栓性能に優れた血管内塞栓促進補綴
材の開発が期待される。血管塞栓用デバイスの血栓塞栓性能評価では以下の項目を検討す
ること。
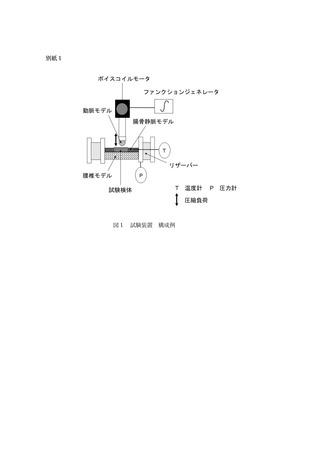
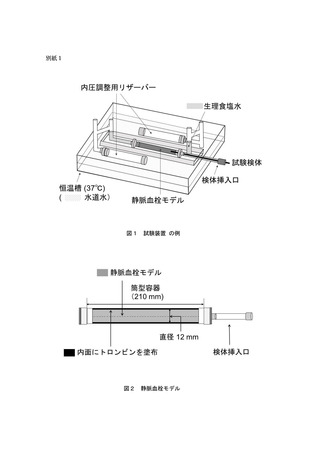
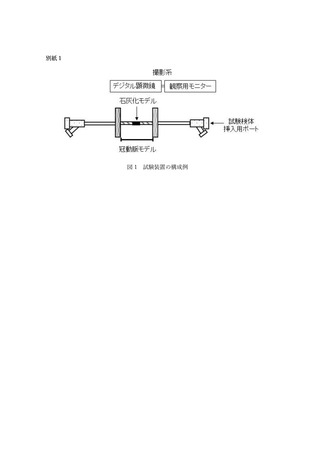
- 試験検体の使用環境を模擬した血液循環回路
19 / 24
1
適用範囲
この規格は、治療デバイスである血管内塞栓促進補綴材の血栓塞栓性能に関する試験方法
を規定する。
2
用語及び定義
この規格で用いる主な用語及び定義は、次による。
2.1 血管内塞栓促進補綴材
動静脈に経皮的に留置し、血栓を形成させ、血流を遮断・改変させるために使用される治療
デバイスである。動静脈奇形、瘤、動静脈瘻等の異常血管、外傷性血管損傷による出血及び
腫瘍等に使用する。
2. 2 血栓塞栓化
塞栓対象とする血管の流れが静止した状態。例えば、平均流量 10 mL/min で臨床的な血栓
塞栓化とみなす。
2.3 血管モデル
評価対象とする血管を人工的に模擬したモデル
2.4 拍動ポンプ
試験回路内の流れを拍動流とするための装置
2.5 最終製品
滅菌を含む全ての製造工程を経た出荷可能な製品
3
血管塞栓用デバイスの血栓塞栓性能試験
3.1 一般
腸骨動脈等血流量の多い領域に対する血管塞栓術では、コイルに比べて逸脱リスクの少な
い血管塞栓用プラグが選択されることがあり、血栓塞栓性能に優れた血管内塞栓促進補綴
材の開発が期待される。血管塞栓用デバイスの血栓塞栓性能評価では以下の項目を検討す
ること。
- 試験検体の使用環境を模擬した血液循環回路
19 / 24