よむ、つかう、まなぶ。
薬-4○関係業界からの意見聴取について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00065.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第203回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
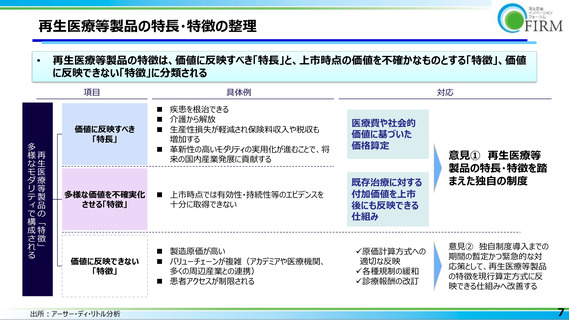
既存医薬品と再生医療等製品の違い(特徴の全体像)
再生医療等製品
規制
研究開発
特許/起源
•
•
ローカルルールで成り立っている
日本の規制(生原基、カルタヘナ)が障壁
•
ICH により国際的に調和
•
多くの特許の組み合わせ
(ライセンス料が増加)
アカデミアやベンチャー起源の製品が多い
•
•
物質特許で保護
アカデミアやベンチャー起源の製品が再生医療
等製品より少ない
•
製造
流通
低分子医薬品・バイオ医薬品
人材
•
高度技術を持つ人材が少なく、
育成していく必要性が高い
•
豊富
医療機関
•
製造の起点として細胞の採材が必要
•
製造にあたり採材は必要としない
製造
•
•
•
モダリティが多様で専用設備が必要
多くの周辺産業との連携が必要
大量生産できずスケールメリットが得難い
品質
•
•
細胞や遺伝子の均質化が困難
総製造量に対して検査用製造の占める割合
が高い
•
•
•
•
•
設備を同じモダリティに流用可能
限られた特定の産業(化学・バイオ)
大量生産可能で工業的
均質化が容易
再生医療等製品よりも総製造量に対して検
査用製造の占める割合が低い
輸送
•
専用の輸送が必要
•
通常設備で輸送可能
医療機関
•
•
専門施設に限定
医師の手技に依存する製品もある
•
広く使用
対象患者
•
•
希少疾患を含め比較的小さい
自家細胞は個別化医療
•
生活習慣病を含め比較的大きい
投与
注:バイオ医薬品などで生じる問題も一部含む
出所:再生医療イノベーションフォラム 再生医療等製品の価格算定 意見書 (2023年4月26日公開)より一部改変
9
再生医療等製品
規制
研究開発
特許/起源
•
•
ローカルルールで成り立っている
日本の規制(生原基、カルタヘナ)が障壁
•
ICH により国際的に調和
•
多くの特許の組み合わせ
(ライセンス料が増加)
アカデミアやベンチャー起源の製品が多い
•
•
物質特許で保護
アカデミアやベンチャー起源の製品が再生医療
等製品より少ない
•
製造
流通
低分子医薬品・バイオ医薬品
人材
•
高度技術を持つ人材が少なく、
育成していく必要性が高い
•
豊富
医療機関
•
製造の起点として細胞の採材が必要
•
製造にあたり採材は必要としない
製造
•
•
•
モダリティが多様で専用設備が必要
多くの周辺産業との連携が必要
大量生産できずスケールメリットが得難い
品質
•
•
細胞や遺伝子の均質化が困難
総製造量に対して検査用製造の占める割合
が高い
•
•
•
•
•
設備を同じモダリティに流用可能
限られた特定の産業(化学・バイオ)
大量生産可能で工業的
均質化が容易
再生医療等製品よりも総製造量に対して検
査用製造の占める割合が低い
輸送
•
専用の輸送が必要
•
通常設備で輸送可能
医療機関
•
•
専門施設に限定
医師の手技に依存する製品もある
•
広く使用
対象患者
•
•
希少疾患を含め比較的小さい
自家細胞は個別化医療
•
生活習慣病を含め比較的大きい
投与
注:バイオ医薬品などで生じる問題も一部含む
出所:再生医療イノベーションフォラム 再生医療等製品の価格算定 意見書 (2023年4月26日公開)より一部改変
9