よむ、つかう、まなぶ。
薬-4○関係業界からの意見聴取について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00065.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第203回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
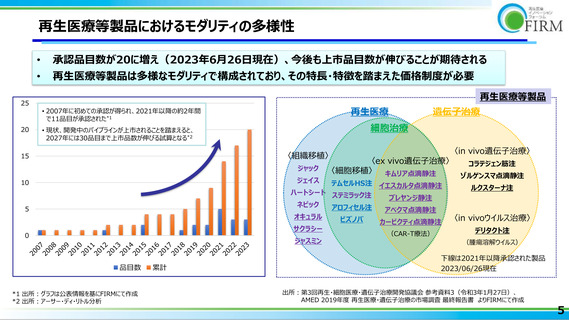
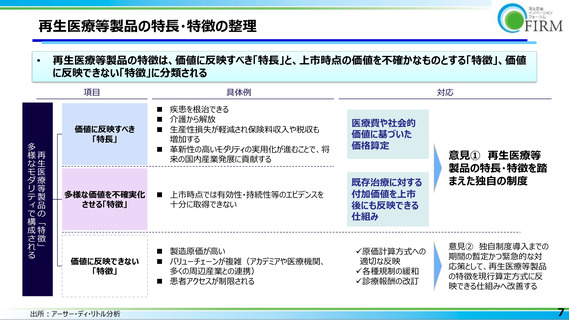
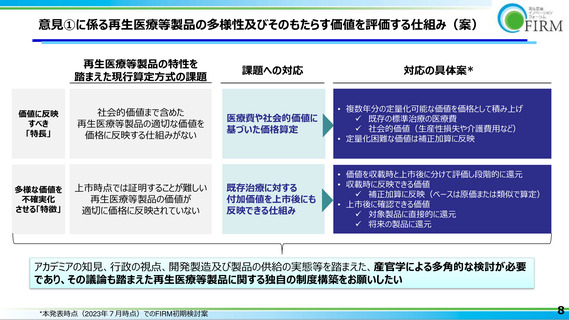
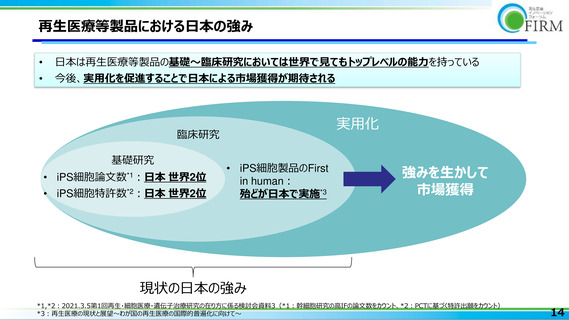
再生医療等製品におけるモダリティの多様性
•
承認品目数が20に増え(2023年6月26日現在)、今後も上市品目数が伸びることが期待される
•
再生医療等製品は多様なモダリティで構成されており、その特長・特徴を踏まえた価格制度が必要
再生医療等製品
25
再生医療
• 2007年に初めての承認が得られ、2021年以降の約2年間
で11品目が承認された*1
20
細胞治療
• 現状、開発中のパイプラインが上市されることを踏まえると、
2027年には30品目まで上市品数が伸びる試算となる*2
〈組織移植〉
15
ジャック
ジェイス
10
遺伝子治療
〈in vivo遺伝子治療〉
〈ex vivo遺伝子治療〉
〈細胞移植〉 キムリア点滴静注
テムセルHS注 イエスカルタ点滴静注
ハートシート ステミラック注
ブレヤンジ静注
ネピック
アロフィセル注
アベクマ点滴静注
オキュラル
ビズノバ
カービクティ点滴静注
サクラシー
5
0
ジャスミン
品目数
*1 出所:グラフは公表情報を基にFIRMにて作成
*2 出所:アーサー・ディ・リトル分析
累計
(CAR-T療法)
コラテジェン筋注
ゾルゲンスマ点滴静注
ルクスターナ注
〈in vivoウイルス治療〉
デリタクト注
(腫瘍溶解ウイルス)
下線は2021年以降承認された製品
2023/06/26現在
出所:第3回再生・細胞医療・遺伝子治療開発協議会 参考資料3(令和3年1月27日)、
AMED 2019年度 再生医療・遺伝子治療の市場調査 最終報告書 よりFIRMにて作成
5
•
承認品目数が20に増え(2023年6月26日現在)、今後も上市品目数が伸びることが期待される
•
再生医療等製品は多様なモダリティで構成されており、その特長・特徴を踏まえた価格制度が必要
再生医療等製品
25
再生医療
• 2007年に初めての承認が得られ、2021年以降の約2年間
で11品目が承認された*1
20
細胞治療
• 現状、開発中のパイプラインが上市されることを踏まえると、
2027年には30品目まで上市品数が伸びる試算となる*2
〈組織移植〉
15
ジャック
ジェイス
10
遺伝子治療
〈in vivo遺伝子治療〉
〈ex vivo遺伝子治療〉
〈細胞移植〉 キムリア点滴静注
テムセルHS注 イエスカルタ点滴静注
ハートシート ステミラック注
ブレヤンジ静注
ネピック
アロフィセル注
アベクマ点滴静注
オキュラル
ビズノバ
カービクティ点滴静注
サクラシー
5
0
ジャスミン
品目数
*1 出所:グラフは公表情報を基にFIRMにて作成
*2 出所:アーサー・ディ・リトル分析
累計
(CAR-T療法)
コラテジェン筋注
ゾルゲンスマ点滴静注
ルクスターナ注
〈in vivoウイルス治療〉
デリタクト注
(腫瘍溶解ウイルス)
下線は2021年以降承認された製品
2023/06/26現在
出所:第3回再生・細胞医療・遺伝子治療開発協議会 参考資料3(令和3年1月27日)、
AMED 2019年度 再生医療・遺伝子治療の市場調査 最終報告書 よりFIRMにて作成
5