よむ、つかう、まなぶ。
05_資料3_製薬団体提出資料(日本製薬工業協会・日本ワクチン産業協会・米国研究製薬工業会・欧州製薬団体連合会合同) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33297.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 研究開発及び生産・流通部会(第32回 5/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
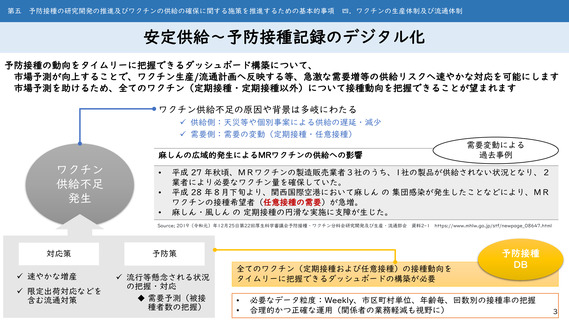
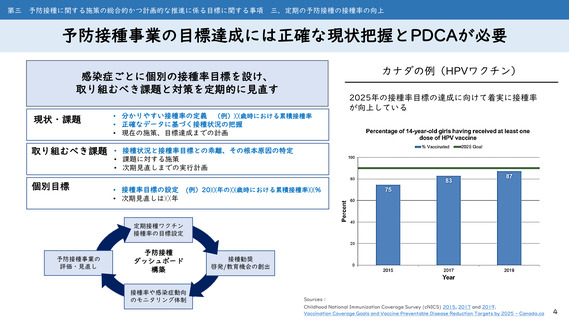
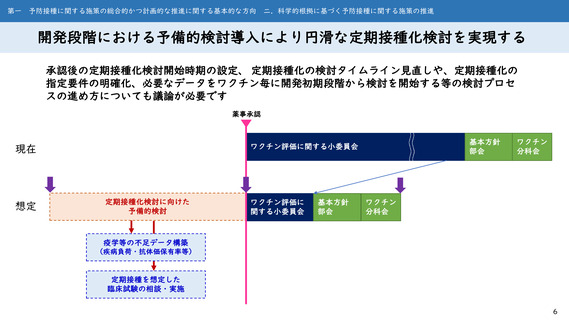
第一 予防接種に関する施策の総合的かつ計画的な推進に関する基本的な方向
二.科学的根拠に基づく予防接種に関する施策の推進
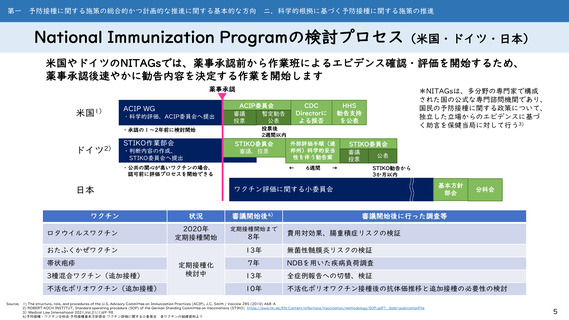
National Immunization Programの検討プロセス(米国・ドイツ・日本)
米国やドイツのNITAGsでは、薬事承認前から作業班によるエビデンス確認・評価を開始するため、
薬事承認後速やかに勧告内容を決定する作業を開始します
薬事承認
米国1)
ACIP委員会
ACIP WG
・科学的評価、ACIP委員会へ提出
STIKO作業部会
STIKO委員会
・判断内容の作成、
STIKO委員会へ提出
審議、投票
・公共の関心が高いワクチンの場合、
認可前に評価プロセスを開始できる
日本
ワクチン
ロタウイルスワクチン
3種混合ワクチン(追加接種)
不活化ポリオワクチン(追加接種)
外部評価手順(連
邦州)科学的妥当
性を伴う勧告案
←
6週間
STIKO委員会
審議
投票
公表
→
STIKO勧告から
3か月以内
基本方針
部会
ワクチン評価に関する小委員会
状況
審議開始後4)
2020年
定期接種開始
定期接種開始まで
おたふくかぜワクチン
帯状疱疹
HHS
勧告支持
を公表
投票後
2週間以内
・承認の1~2年前に検討開始
ドイツ2)
CDC
Directorに
よる採否
暫定勧告
公表
審議
投票
*NITAGsは、多分野の専門家で構成
された国の公式な専門諮問機関であり、
国民の予防接種に関する政策について、
独立した立場からのエビデンスに基づ
く助言を保健当局に対して行う3)
定期接種化
検討中
8年
分科会
審議開始後に行った調査等
費用対効果、腸重積症リスクの検証
13年
無菌性髄膜炎リスクの検証
7年
NDBを用いた疾病負荷調査
13年
全症例報告への切替、検証
10年
不活化ポリオワクチン接種後の抗体価推移と追加接種の必要性の検討
Source; 1) The structure, role, and procedures of the U.S. Advisory Committee on Immunization Practices (ACIP), J.C. Smith / Vaccine 28S (2010) A68–A
2) ROBERT KOCH INSTITUT, Standard operating procedure (SOP) of the German Standing Committee on Vaccinations (STIKO) https://www.rki.de/EN/Content/infections/Vaccination/methodology/SOP.pdf?__blob=publicationFile
3)Medical Law International 2021,Vol.21(1)69–98
4)予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会 各ワクチンの経緯資料より
5
二.科学的根拠に基づく予防接種に関する施策の推進
National Immunization Programの検討プロセス(米国・ドイツ・日本)
米国やドイツのNITAGsでは、薬事承認前から作業班によるエビデンス確認・評価を開始するため、
薬事承認後速やかに勧告内容を決定する作業を開始します
薬事承認
米国1)
ACIP委員会
ACIP WG
・科学的評価、ACIP委員会へ提出
STIKO作業部会
STIKO委員会
・判断内容の作成、
STIKO委員会へ提出
審議、投票
・公共の関心が高いワクチンの場合、
認可前に評価プロセスを開始できる
日本
ワクチン
ロタウイルスワクチン
3種混合ワクチン(追加接種)
不活化ポリオワクチン(追加接種)
外部評価手順(連
邦州)科学的妥当
性を伴う勧告案
←
6週間
STIKO委員会
審議
投票
公表
→
STIKO勧告から
3か月以内
基本方針
部会
ワクチン評価に関する小委員会
状況
審議開始後4)
2020年
定期接種開始
定期接種開始まで
おたふくかぜワクチン
帯状疱疹
HHS
勧告支持
を公表
投票後
2週間以内
・承認の1~2年前に検討開始
ドイツ2)
CDC
Directorに
よる採否
暫定勧告
公表
審議
投票
*NITAGsは、多分野の専門家で構成
された国の公式な専門諮問機関であり、
国民の予防接種に関する政策について、
独立した立場からのエビデンスに基づ
く助言を保健当局に対して行う3)
定期接種化
検討中
8年
分科会
審議開始後に行った調査等
費用対効果、腸重積症リスクの検証
13年
無菌性髄膜炎リスクの検証
7年
NDBを用いた疾病負荷調査
13年
全症例報告への切替、検証
10年
不活化ポリオワクチン接種後の抗体価推移と追加接種の必要性の検討
Source; 1) The structure, role, and procedures of the U.S. Advisory Committee on Immunization Practices (ACIP), J.C. Smith / Vaccine 28S (2010) A68–A
2) ROBERT KOCH INSTITUT, Standard operating procedure (SOP) of the German Standing Committee on Vaccinations (STIKO) https://www.rki.de/EN/Content/infections/Vaccination/methodology/SOP.pdf?__blob=publicationFile
3)Medical Law International 2021,Vol.21(1)69–98
4)予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会 各ワクチンの経緯資料より
5