よむ、つかう、まなぶ。
総-9○患者申出療養評価会議からの報告について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00177.html |
| 出典情報 | 中央社会保険医療協議会 総会(第540回 3/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
Secondary endpoints:
無増悪生存期間、全生存期間、病勢制御割合、有害事象発現割合
予定登録数と研究期間
予定登録数:10 例
登録期間:約 2 年(jRCT 公表日~2025 年 2 月 28 日予定)
追跡期間:登録終了後 2 年間(2025 年 3 月1日~2027 年 2 月 28 日)
解析期間:1 年(2027 年 3 月1日~2028 年 2 月 29 日)
総研究期間:5 年(jRCT 公表日~2028 年 2 月 29 日)
(効果)
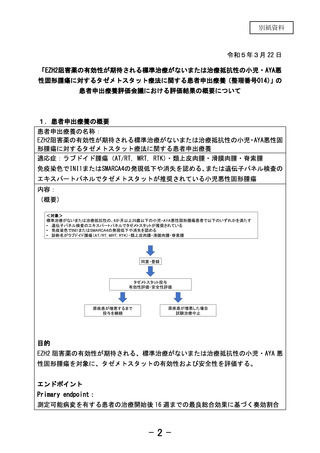
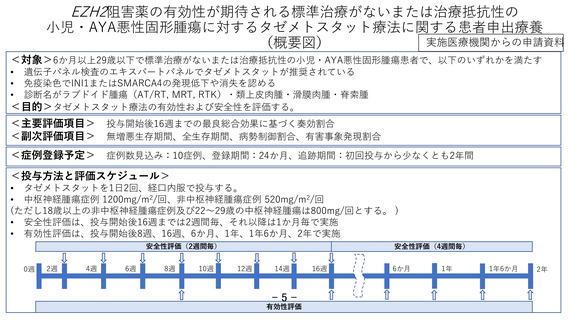
今回の研究は EZH2 阻害薬の有効性が期待される、標準治療がないまたは治療抵抗性の
小児悪性固形腫瘍を対象に、タゼメトスタットの有効性および安全性を評価する。当
該研究結果を試験薬提供企業であるエーザイ株式会社と共有し,有効性が確認された
場合には,当該企業による企業治験又は医師主導治験の実施を含め薬事承認申請まで
の道筋を検討する。
本研究を行うことにより、治療開発が難渋する小児・AYA 悪性固形腫瘍に罹患した患
者にとって有望な薬剤を利用する機会を提供することができる。本研究は探索的な結
果しか得られないとはいえ、治療開発が難渋する小児・AYA 悪性固形腫瘍において有
望な薬剤を提供できる可能性を高めることに繋がる。また、がん遺伝子パネル検査の
結果や免疫染色の結果といったバイオマーカーの意義を検討し、治療開発が難渋する
小児・AYA 悪性固形腫瘍においてバイオマーカーに基づいた薬剤開発に繋がる可能性
がある。
(患者申出療養に係る費用)
本研究に係る費用は 19,584,014 円である。このうち患者申出療養に係る費用は
17,546,864 円であるが、すべてエーザイ株式会社より無償で提供される。よって患者
負担額は 620,817 円である(3 割負担の場合)。
臨床研究中核病院
国立がん研究センター中央病院
協力医療機関
なし
2.患者申出療養評価会議における審議概要及び審議結果
(1)開催日時:令和5年1月 20 日(金)
第 37 回患者申出療養評価会議
(2)審議概要及び審議結果
-3-
無増悪生存期間、全生存期間、病勢制御割合、有害事象発現割合
予定登録数と研究期間
予定登録数:10 例
登録期間:約 2 年(jRCT 公表日~2025 年 2 月 28 日予定)
追跡期間:登録終了後 2 年間(2025 年 3 月1日~2027 年 2 月 28 日)
解析期間:1 年(2027 年 3 月1日~2028 年 2 月 29 日)
総研究期間:5 年(jRCT 公表日~2028 年 2 月 29 日)
(効果)
今回の研究は EZH2 阻害薬の有効性が期待される、標準治療がないまたは治療抵抗性の
小児悪性固形腫瘍を対象に、タゼメトスタットの有効性および安全性を評価する。当
該研究結果を試験薬提供企業であるエーザイ株式会社と共有し,有効性が確認された
場合には,当該企業による企業治験又は医師主導治験の実施を含め薬事承認申請まで
の道筋を検討する。
本研究を行うことにより、治療開発が難渋する小児・AYA 悪性固形腫瘍に罹患した患
者にとって有望な薬剤を利用する機会を提供することができる。本研究は探索的な結
果しか得られないとはいえ、治療開発が難渋する小児・AYA 悪性固形腫瘍において有
望な薬剤を提供できる可能性を高めることに繋がる。また、がん遺伝子パネル検査の
結果や免疫染色の結果といったバイオマーカーの意義を検討し、治療開発が難渋する
小児・AYA 悪性固形腫瘍においてバイオマーカーに基づいた薬剤開発に繋がる可能性
がある。
(患者申出療養に係る費用)
本研究に係る費用は 19,584,014 円である。このうち患者申出療養に係る費用は
17,546,864 円であるが、すべてエーザイ株式会社より無償で提供される。よって患者
負担額は 620,817 円である(3 割負担の場合)。
臨床研究中核病院
国立がん研究センター中央病院
協力医療機関
なし
2.患者申出療養評価会議における審議概要及び審議結果
(1)開催日時:令和5年1月 20 日(金)
第 37 回患者申出療養評価会議
(2)審議概要及び審議結果
-3-