よむ、つかう、まなぶ。
参考資料2 調査結果報告書 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31125.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第25回 2/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
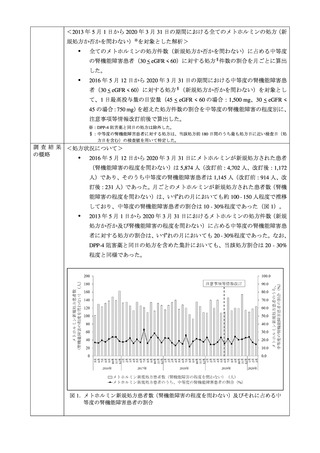
-4 阻害薬を有効成分とする単剤及び配合剤(以下、「DPP-4 阻害薬」)が新規処方
された中等度の腎機能障害患者も対象とした。なお、メトホルミンと DPP-4 阻害薬
の併用及びその配合剤が新規処方された患者は対象から除外し、医薬品の新規処方
については初回処方前 180 日間に対象とする医薬品の処方がないことと定義した。
なお、メトホルミンの適正使用に関する Recommendation の改訂(2016 年 5 月 12
日)に伴い、注意事項等情報の改訂前からメトホルミンの処方実態が変化していた
かを確認する目的で、副次的に 2013 年 5 月 1 日から 2020 年 3 月 31 日の期間にお
ける全てのメトホルミンの処方(新規処方か否かを問わない)を対象とした解析も
実施した。
†:2016 年 5 月 12 日に日本糖尿病学会がメトホルミンの適正使用に関する Recommendation を改訂し、腎機
能に関するメトホルミンの投与禁忌の対象を eGFR が 30 未満の患者とする旨を公表していることを踏ま
え、当該日を組入れ期間の開始日とした。
腎機能障害の定義:
腎機能は eGFR にて定義し、中等度の腎機能障害を eGFR が 30 以上 60 未満と設定
した。患者ごとの腎機能は、初回処方前 180 日間のうち最も初回処方日に近い検査
日(初回処方日を含む)の検査値を用いた。
アウトカム:
乳酸アシドーシスについては、臨床検査値を用いて、血中乳酸濃度が 45 mg/dl 以上
かつ pH が 7.35 未満と定義し、この定義を同日に満たした検査日を乳酸アシドーシ
スの発現日とした。また、高乳酸血症についても、臨床検査値を用いて、血中乳酸
濃度が 36 mg/dl 以上と定義し、この定義を満たした日を高乳酸血症の発現日とした。
追跡期間:
メトホルミン又は DPP-4 阻害薬が新規処方された日の翌日を起点として、①処方継
続期間‡の終了日に医薬品の飲み残し等を考慮して 30 日を加えた日、②データ期間
における最終の診療記録日、③アウトカムの発現日、④2019 年 6 月 17 日(改訂前
のみに適用)又は⑤メトホルミンが新規処方された患者においては DPP-4 阻害薬の
処方日(DPP-4 阻害薬が新規処方された患者においてはメトホルミンの処方日)の
うち、最も早い日までの期間とした。
‡:先行する処方期間の終了日と後続の処方期間の開始日が 30 日未満の場合に、処方が継続しているとみな
して連結した期間
解析項目及び方法:
<2016 年 5 月 12 日から 2020 年 3 月 31 日までの期間にメトホルミンが新規処方された
患者を対象とした解析>
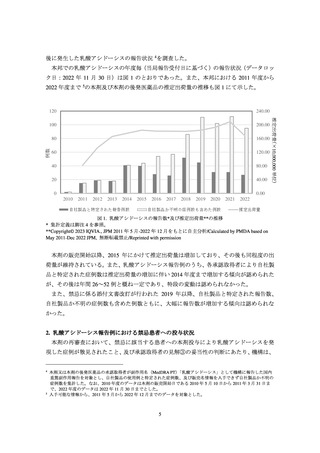
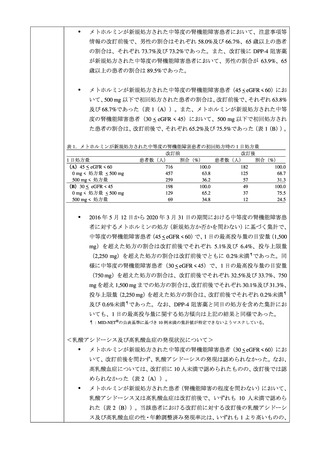
メトホルミンが新規処方された患者数及びそれに占める中等度の腎機能障害患
者の割合を月ごとに算出した。
メトホルミンが新規処方された中等度の腎機能障害患者において、メトホルミ
ンの初回処方時の 1 日処方量(mg)を集計した。
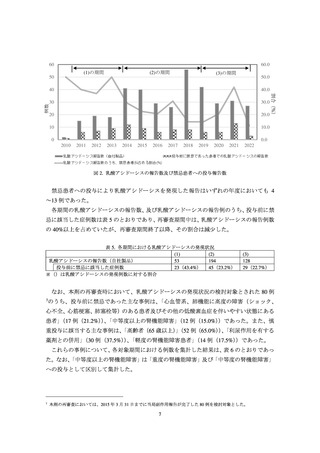
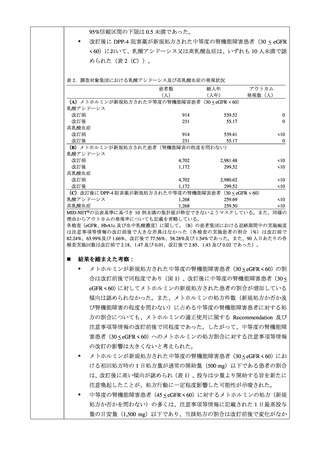
メトホルミンが新規処方された中等度の腎機能障害患者を対象に、乳酸アシド
ーシス及び高乳酸血症について、改訂前後の発現数等を集計した。また、改訂
後に DPP-4 阻害薬が新規処方された中等度の腎機能障害患者を対象に、同様の
集計を実施した。
された中等度の腎機能障害患者も対象とした。なお、メトホルミンと DPP-4 阻害薬
の併用及びその配合剤が新規処方された患者は対象から除外し、医薬品の新規処方
については初回処方前 180 日間に対象とする医薬品の処方がないことと定義した。
なお、メトホルミンの適正使用に関する Recommendation の改訂(2016 年 5 月 12
日)に伴い、注意事項等情報の改訂前からメトホルミンの処方実態が変化していた
かを確認する目的で、副次的に 2013 年 5 月 1 日から 2020 年 3 月 31 日の期間にお
ける全てのメトホルミンの処方(新規処方か否かを問わない)を対象とした解析も
実施した。
†:2016 年 5 月 12 日に日本糖尿病学会がメトホルミンの適正使用に関する Recommendation を改訂し、腎機
能に関するメトホルミンの投与禁忌の対象を eGFR が 30 未満の患者とする旨を公表していることを踏ま
え、当該日を組入れ期間の開始日とした。
腎機能障害の定義:
腎機能は eGFR にて定義し、中等度の腎機能障害を eGFR が 30 以上 60 未満と設定
した。患者ごとの腎機能は、初回処方前 180 日間のうち最も初回処方日に近い検査
日(初回処方日を含む)の検査値を用いた。
アウトカム:
乳酸アシドーシスについては、臨床検査値を用いて、血中乳酸濃度が 45 mg/dl 以上
かつ pH が 7.35 未満と定義し、この定義を同日に満たした検査日を乳酸アシドーシ
スの発現日とした。また、高乳酸血症についても、臨床検査値を用いて、血中乳酸
濃度が 36 mg/dl 以上と定義し、この定義を満たした日を高乳酸血症の発現日とした。
追跡期間:
メトホルミン又は DPP-4 阻害薬が新規処方された日の翌日を起点として、①処方継
続期間‡の終了日に医薬品の飲み残し等を考慮して 30 日を加えた日、②データ期間
における最終の診療記録日、③アウトカムの発現日、④2019 年 6 月 17 日(改訂前
のみに適用)又は⑤メトホルミンが新規処方された患者においては DPP-4 阻害薬の
処方日(DPP-4 阻害薬が新規処方された患者においてはメトホルミンの処方日)の
うち、最も早い日までの期間とした。
‡:先行する処方期間の終了日と後続の処方期間の開始日が 30 日未満の場合に、処方が継続しているとみな
して連結した期間
解析項目及び方法:
<2016 年 5 月 12 日から 2020 年 3 月 31 日までの期間にメトホルミンが新規処方された
患者を対象とした解析>
メトホルミンが新規処方された患者数及びそれに占める中等度の腎機能障害患
者の割合を月ごとに算出した。
メトホルミンが新規処方された中等度の腎機能障害患者において、メトホルミ
ンの初回処方時の 1 日処方量(mg)を集計した。
メトホルミンが新規処方された中等度の腎機能障害患者を対象に、乳酸アシド
ーシス及び高乳酸血症について、改訂前後の発現数等を集計した。また、改訂
後に DPP-4 阻害薬が新規処方された中等度の腎機能障害患者を対象に、同様の
集計を実施した。