よむ、つかう、まなぶ。
資料1-2緊急承認関係リーフレット (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30193.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和4年度第2回 1/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
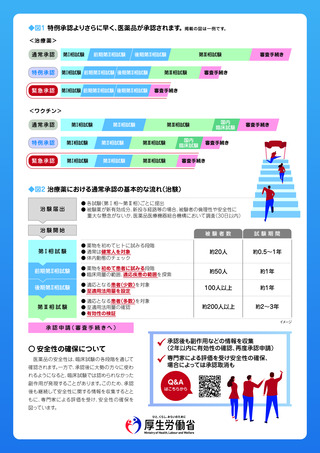
◆図1 特例承認よりさらに早く、医薬品が承認されます。掲載の図は一例です。
<治療薬>
通常承認
第Ⅰ相試験
特例承認
第Ⅰ相試験 前期第Ⅱ相試験 後期第Ⅱ相試験
緊急承認
第Ⅰ相試験 前期第Ⅱ相試験 後期第Ⅱ相試験
前期第Ⅱ相試験
後期第Ⅱ相試験
第Ⅲ相試験
第Ⅲ相試験
審査手続き
審査手続き
審査手続き
<ワクチン>
通常承認
第Ⅰ相試験
特例承認
第Ⅰ相試験
緊急承認
第Ⅰ相試験
第Ⅱ相試験
第Ⅱ相試験
第Ⅱ相試験
国内
臨床試験
第Ⅲ相試験
国内
臨床試験
第Ⅲ相試験
第Ⅲ相試験
審査手続き
審査手続き
審査手続き
◆図2 治療薬における通常承認の基本的な流れ(治験)
治験届出
● 各試験(第Ⅰ相〜第Ⅲ相)ごとに提出
● 被験薬が新有効成分、新投与経路等の場合、被験者の倫理性や安全性に
重大な懸念がないか、医薬品医療機器総合機構において調査(30日以内)
治験開始
被験者数
試験期間
● 薬物を初めてヒトに試みる段階
● 通常は健常人を対象
● 体内動態のチェック
約20人
約0.5〜1年
前期第Ⅱ相試験
● 薬物を初めて患者に試みる段階
● 臨床用量の範囲、
適応疾患の範囲を探索
約50人
約1年
後期第Ⅱ相試験
● 適応となる患者(少数)
を対象
● 至適用法用量を設定
100人以上
約1年
第Ⅲ相 試 験
● 適応となる患者(多数)
を対象
● 至適用法用量の確認
● 有効性の検証
約200人以上
約2〜3年
第Ⅰ相 試 験
イメージ
承 認 申 請( 審 査 手 続 き へ )
○ 安全性の確保について
医薬品の安全性は、臨床試験の各段階を通じて
確認されます。一方で、承認後に大勢の方々に使わ
れるようになると、臨床試験では認められなかった
副作用が発現することがあります。
このため、承認
後も継続して安全性に関する情報を収集するとと
もに、専門家による評価を受け、安全性の確保を
図っています。
承認後も副作用などの情報を収集
(2年以内に有効性の確認、再度承認申請)
専門家による評価を受け安全性の確保、
場合によっては承認取消も
Q&A
はこちらから
<治療薬>
通常承認
第Ⅰ相試験
特例承認
第Ⅰ相試験 前期第Ⅱ相試験 後期第Ⅱ相試験
緊急承認
第Ⅰ相試験 前期第Ⅱ相試験 後期第Ⅱ相試験
前期第Ⅱ相試験
後期第Ⅱ相試験
第Ⅲ相試験
第Ⅲ相試験
審査手続き
審査手続き
審査手続き
<ワクチン>
通常承認
第Ⅰ相試験
特例承認
第Ⅰ相試験
緊急承認
第Ⅰ相試験
第Ⅱ相試験
第Ⅱ相試験
第Ⅱ相試験
国内
臨床試験
第Ⅲ相試験
国内
臨床試験
第Ⅲ相試験
第Ⅲ相試験
審査手続き
審査手続き
審査手続き
◆図2 治療薬における通常承認の基本的な流れ(治験)
治験届出
● 各試験(第Ⅰ相〜第Ⅲ相)ごとに提出
● 被験薬が新有効成分、新投与経路等の場合、被験者の倫理性や安全性に
重大な懸念がないか、医薬品医療機器総合機構において調査(30日以内)
治験開始
被験者数
試験期間
● 薬物を初めてヒトに試みる段階
● 通常は健常人を対象
● 体内動態のチェック
約20人
約0.5〜1年
前期第Ⅱ相試験
● 薬物を初めて患者に試みる段階
● 臨床用量の範囲、
適応疾患の範囲を探索
約50人
約1年
後期第Ⅱ相試験
● 適応となる患者(少数)
を対象
● 至適用法用量を設定
100人以上
約1年
第Ⅲ相 試 験
● 適応となる患者(多数)
を対象
● 至適用法用量の確認
● 有効性の検証
約200人以上
約2〜3年
第Ⅰ相 試 験
イメージ
承 認 申 請( 審 査 手 続 き へ )
○ 安全性の確保について
医薬品の安全性は、臨床試験の各段階を通じて
確認されます。一方で、承認後に大勢の方々に使わ
れるようになると、臨床試験では認められなかった
副作用が発現することがあります。
このため、承認
後も継続して安全性に関する情報を収集するとと
もに、専門家による評価を受け、安全性の確保を
図っています。
承認後も副作用などの情報を収集
(2年以内に有効性の確認、再度承認申請)
専門家による評価を受け安全性の確保、
場合によっては承認取消も
Q&A
はこちらから