よむ、つかう、まなぶ。
資料1-2緊急承認関係リーフレット (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30193.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和4年度第2回 1/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
資料1-2
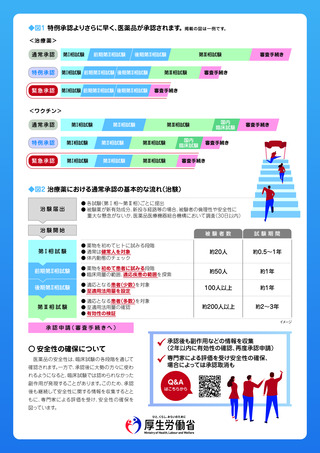
治療薬
緊急承認制度
ワクチン
が施行されました
○ 緊急承認制度とは
○ これまでの特例承認との違いは
今回の新型コロナの対応において、治療薬やワクチンを
これまでの特例承認では、海外で流通している医薬品等
迅速に承認・供給するため、治療薬等について
「特例承認」
を
を対象に、有効性と安全性の両方を早急に
「確認」
し、
迅速な
行ってまいりました。一方で、
より早期に承認することができ
承認を行ってきました。新たな緊急承認制度においては、海
れば、
さらに有効な感染症対策が行える可能性があること
外でまだ流通していない医薬品等も対象とし、安全性の「確
から、特例承認より更に迅速に承認を行うことができる制度
認」は前提とする一方で、有効性が「推定」
できれば承認する
として、
「緊急承認制度」
を創設いたしました。
ことができることとしました。
通常承認
対象
すべての
医薬品等
特例承認
海外で流通している医薬品等
(緊急時に健康被害の拡大を防止するため、当該
医薬品等の使用以外に適当な方法がない場合)
緊急承認
すべての医薬品等
(緊急時に健康被害の拡大を防止するため、当該医薬品等
の使用以外に適当な方法がない場合)
有効性
確認
確認
推定
安全性
確認
確認
確認
GMP調査※・国家検定・容器包装の表示等
GMP調査※・国家検定・容器包装の表示等
特例措置
※)GMP調査:医薬品がきちんと製造できているか、工場ごとに調査して確認を行うもの。
○ 有効性の推定、安全性の確認とは
医薬品等の有効性・安全性は臨床試験(治験)
を通じて確認を行いますが、裏面図1のように段階的に行われ、
それぞれ被験者
の数、試験期間、確認できる内容等が異なります。
緊急承認においては、通常の承認で必要な臨床試験が完了していないものについても、有効性が推定されれば、条件を付して
承認することができます。
通常承認
治療薬
ワクチン
緊急承認
検証的な臨床試験(第Ⅲ相試験)の実施。
探索的な臨床試験(後期第Ⅱ相試験)
で有効性が認
められれば承認可能。
人種差・地域差等がないことの確認のために国内治験を
実施。
海外での大規模な検証的臨床試験の結果のみでも
承認可能。
※ワクチンについては、技術革新や医学の進歩等に伴い、疾患の特性やワクチンの特性に応じて大規模な検証的臨床試験以外の結果を用いて有効性を推定できる可能性もある。
治療薬
緊急承認制度
ワクチン
が施行されました
○ 緊急承認制度とは
○ これまでの特例承認との違いは
今回の新型コロナの対応において、治療薬やワクチンを
これまでの特例承認では、海外で流通している医薬品等
迅速に承認・供給するため、治療薬等について
「特例承認」
を
を対象に、有効性と安全性の両方を早急に
「確認」
し、
迅速な
行ってまいりました。一方で、
より早期に承認することができ
承認を行ってきました。新たな緊急承認制度においては、海
れば、
さらに有効な感染症対策が行える可能性があること
外でまだ流通していない医薬品等も対象とし、安全性の「確
から、特例承認より更に迅速に承認を行うことができる制度
認」は前提とする一方で、有効性が「推定」
できれば承認する
として、
「緊急承認制度」
を創設いたしました。
ことができることとしました。
通常承認
対象
すべての
医薬品等
特例承認
海外で流通している医薬品等
(緊急時に健康被害の拡大を防止するため、当該
医薬品等の使用以外に適当な方法がない場合)
緊急承認
すべての医薬品等
(緊急時に健康被害の拡大を防止するため、当該医薬品等
の使用以外に適当な方法がない場合)
有効性
確認
確認
推定
安全性
確認
確認
確認
GMP調査※・国家検定・容器包装の表示等
GMP調査※・国家検定・容器包装の表示等
特例措置
※)GMP調査:医薬品がきちんと製造できているか、工場ごとに調査して確認を行うもの。
○ 有効性の推定、安全性の確認とは
医薬品等の有効性・安全性は臨床試験(治験)
を通じて確認を行いますが、裏面図1のように段階的に行われ、
それぞれ被験者
の数、試験期間、確認できる内容等が異なります。
緊急承認においては、通常の承認で必要な臨床試験が完了していないものについても、有効性が推定されれば、条件を付して
承認することができます。
通常承認
治療薬
ワクチン
緊急承認
検証的な臨床試験(第Ⅲ相試験)の実施。
探索的な臨床試験(後期第Ⅱ相試験)
で有効性が認
められれば承認可能。
人種差・地域差等がないことの確認のために国内治験を
実施。
海外での大規模な検証的臨床試験の結果のみでも
承認可能。
※ワクチンについては、技術革新や医学の進歩等に伴い、疾患の特性やワクチンの特性に応じて大規模な検証的臨床試験以外の結果を用いて有効性を推定できる可能性もある。