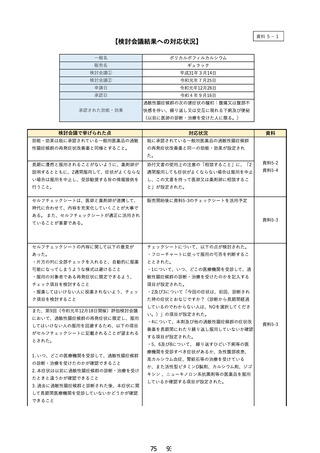
よむ、つかう、まなぶ。
資料5 ポリカルボフィルカルシウム (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198111_00021.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第23回 12/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
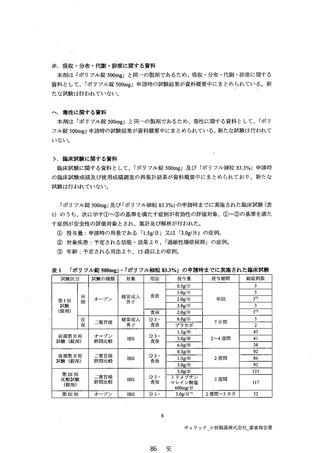
ホ. 吸収・分布・代謝・排港に関する資料
本剤は「ポリフル錠 300mg」と同一の製草であるため、 吸収・分布・代謝・排港に関する
資料として、「ポリフル錠 500mg」申請時の試験結果が資料概要中にまとめられている。新
たな試験は行わんていない。
へ、 毒性に関する資料
本剤は「ポリフル錠 300mg」と同一の製剤であるため、毒性に関する資料として、「ポリ
フル錠 S00mg」 申請時の試験結果が資料払要中にまとめられている。 新たな試験は行われて
いなし \
ト. 臨床試験に関する資料
臨床試験に関する資料として、「ポリフル錠 500mg」及び「ポリフル細粒 83.3%」 申請時
の臨床試験成績及び使用成績調査の再集計結果が資料概要中にまとめられており、新たな
試験は行われていない。
「ポリフプル錠 300mg」 及び「ポリフル細粒 83.39%%」 の申請時までに実施された臨床試験 (表
1) のうち、次に示す①て③の基準を満たす症例が有効性の評価対象、①て②の基準を満た
す症例が安全性の評価対象とされ、集計及び解析が行われた。
① 投与量 : 申請時の用量である「1.5g日」又は「3.0g/日」 の症例。
② 対象疾患 : 予定される効能・効果より、「過敏性腸症候群」の症例。
③ 年齢 : 予定される用法より、13 歳以上の症例。
表1 「ポリフル錠 S00mg」・「ポリフル細粒 83.39%%」 の申請時までに実施された臨床試験
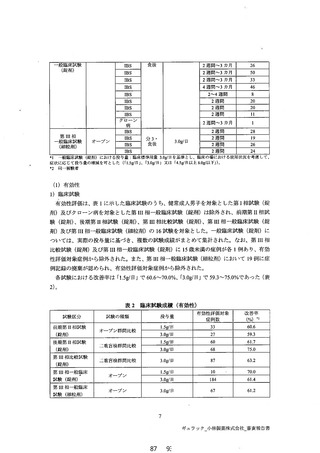
距験区分 試験本種類 対象 用法 投与量 投与期間 総症例数
0.5g日 3
ーー 。 1.0g日 3
第1相 オープン 短介大人 信人 2.0g昌 単回 3
試験 3.0g晶 3
(錠剤) 食前 2.0g日 3
反 ーー 健常成人 | 分3・ 6.0g日 う
復 | 一更百検 | 男子 | 食後 | プラセボ 7月間 2
前期第T 相 +ーま の3 1.5g日 43
用 ープデジ フ * +
を BS レン 3.0g/日 2一4 週間 41
試験 (錠剤) 群問比較 食後 60g 35
後期第TI 相 -生吾栓 分 3 な ー
。 二忠申 IBS イン 1.5g/晶 2 週間 86
試 (錠剤) 群問比較 食後 3.0g 92
3.0g/日 121
第 if 相 ーー
要可燈 。」 生間比較 | PS | 食後 | マレイン酸電| 17
(錠剤)
600me/晶
第 1 相 オープン IBS 分 3・ 3.0g日! 2 週間3 カ月 32
6
ギュラック 小林製薬株式会社 審査報告書
66 9
本剤は「ポリフル錠 300mg」と同一の製草であるため、 吸収・分布・代謝・排港に関する
資料として、「ポリフル錠 500mg」申請時の試験結果が資料概要中にまとめられている。新
たな試験は行わんていない。
へ、 毒性に関する資料
本剤は「ポリフル錠 300mg」と同一の製剤であるため、毒性に関する資料として、「ポリ
フル錠 S00mg」 申請時の試験結果が資料払要中にまとめられている。 新たな試験は行われて
いなし \
ト. 臨床試験に関する資料
臨床試験に関する資料として、「ポリフル錠 500mg」及び「ポリフル細粒 83.3%」 申請時
の臨床試験成績及び使用成績調査の再集計結果が資料概要中にまとめられており、新たな
試験は行われていない。
「ポリフプル錠 300mg」 及び「ポリフル細粒 83.39%%」 の申請時までに実施された臨床試験 (表
1) のうち、次に示す①て③の基準を満たす症例が有効性の評価対象、①て②の基準を満た
す症例が安全性の評価対象とされ、集計及び解析が行われた。
① 投与量 : 申請時の用量である「1.5g日」又は「3.0g/日」 の症例。
② 対象疾患 : 予定される効能・効果より、「過敏性腸症候群」の症例。
③ 年齢 : 予定される用法より、13 歳以上の症例。
表1 「ポリフル錠 S00mg」・「ポリフル細粒 83.39%%」 の申請時までに実施された臨床試験
距験区分 試験本種類 対象 用法 投与量 投与期間 総症例数
0.5g日 3
ーー 。 1.0g日 3
第1相 オープン 短介大人 信人 2.0g昌 単回 3
試験 3.0g晶 3
(錠剤) 食前 2.0g日 3
反 ーー 健常成人 | 分3・ 6.0g日 う
復 | 一更百検 | 男子 | 食後 | プラセボ 7月間 2
前期第T 相 +ーま の3 1.5g日 43
用 ープデジ フ * +
を BS レン 3.0g/日 2一4 週間 41
試験 (錠剤) 群問比較 食後 60g 35
後期第TI 相 -生吾栓 分 3 な ー
。 二忠申 IBS イン 1.5g/晶 2 週間 86
試 (錠剤) 群問比較 食後 3.0g 92
3.0g/日 121
第 if 相 ーー
要可燈 。」 生間比較 | PS | 食後 | マレイン酸電| 17
(錠剤)
600me/晶
第 1 相 オープン IBS 分 3・ 3.0g日! 2 週間3 カ月 32
6
ギュラック 小林製薬株式会社 審査報告書
66 9