よむ、つかう、まなぶ。
○答申について-3-1 (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00139.html |
| 出典情報 | 中央社会保険医療協議会 総会(第516回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
④
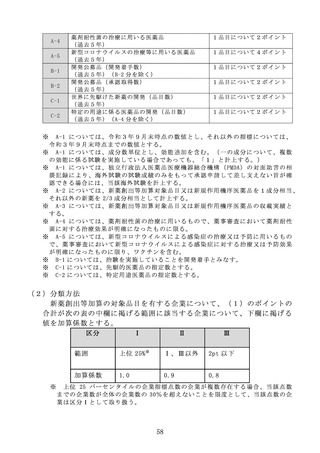
新規作用機序医薬品(薬価収載時に薬理作用類似薬がなしとされた医
薬品をいう。)又は新規作用機序医薬品に相当すると認められる効能若
しくは効果が追加されたもの(既存の効能又は効果の対象患者の限定を
解除したもの等、既存の効能と類似性が高いと認められる効能追加等の
場合を除く。)であって、別表 10 の基準に該当する医薬品
⑤ 薬価収載時に薬理作用類似薬が1又は2であり、かつ最も早く収載さ
れた薬理作用類似薬の収載から3年以内に収載された医薬品であって、
薬理作用類似薬のうち最も早く収載された医薬品が加算適用品又は別表
10 の基準に該当するもの
⑥ 先駆的医薬品であって、当該医薬品の指定に係る効能又は効果又は用
法及び用量について承認を受けているもの
⑦ 特定用途医薬品であって、当該医薬品の指定に係る効能又は効果又は
用法及び用量について承認を受けているもの
⑧ 薬剤耐性菌の治療に用いる医薬品
ハ 第2章第3部5の規定により薬価算定されることとなる配合剤(補正加
算の対象とならないものに限る。)に相当すると認められるものについて
は、薬価収載の日から 15 年を経過した既収載品の有効成分又は後発品が薬
価収載されている既収載品の有効成分を含有するものでないこと
ニ 第5節の再算定(薬価改定の際の再算定に限る。)のいずれにも該当し
ないこと
(2)対象企業
新薬創出等加算の対象企業は、未承認薬等検討会議における検討結果を踏
まえ、厚生労働省から開発を要請された品目について、開発の拒否、合理的
な理由のない開発の遅延等、適切に対応を行わなかった企業以外の企業とす
る。
(3)薬価の改定方式
(1)に該当する品目については、(2)に掲げる企業が製造販売するも
のに限り、本規定の適用前の価格に、別表 11 に定める額を加えた額に改定す
る。
2
控除
これまで新薬創出等加算を受けたことのある既収載品について、初めて次の
要件のいずれかに該当した場合は、これまで受けた新薬創出等加算の累積額を
本規定の適用前の価格から控除する。
イ 当該既収載品に係る後発品が薬価収載されていること
ロ 薬価収載の日から 15 年を経過していること
ハ 第2章第3部5の規定により薬価算定されることとなる配合剤(補正加算
の対象とならないものに限る。)に相当すると認められるものについては、
39
新規作用機序医薬品(薬価収載時に薬理作用類似薬がなしとされた医
薬品をいう。)又は新規作用機序医薬品に相当すると認められる効能若
しくは効果が追加されたもの(既存の効能又は効果の対象患者の限定を
解除したもの等、既存の効能と類似性が高いと認められる効能追加等の
場合を除く。)であって、別表 10 の基準に該当する医薬品
⑤ 薬価収載時に薬理作用類似薬が1又は2であり、かつ最も早く収載さ
れた薬理作用類似薬の収載から3年以内に収載された医薬品であって、
薬理作用類似薬のうち最も早く収載された医薬品が加算適用品又は別表
10 の基準に該当するもの
⑥ 先駆的医薬品であって、当該医薬品の指定に係る効能又は効果又は用
法及び用量について承認を受けているもの
⑦ 特定用途医薬品であって、当該医薬品の指定に係る効能又は効果又は
用法及び用量について承認を受けているもの
⑧ 薬剤耐性菌の治療に用いる医薬品
ハ 第2章第3部5の規定により薬価算定されることとなる配合剤(補正加
算の対象とならないものに限る。)に相当すると認められるものについて
は、薬価収載の日から 15 年を経過した既収載品の有効成分又は後発品が薬
価収載されている既収載品の有効成分を含有するものでないこと
ニ 第5節の再算定(薬価改定の際の再算定に限る。)のいずれにも該当し
ないこと
(2)対象企業
新薬創出等加算の対象企業は、未承認薬等検討会議における検討結果を踏
まえ、厚生労働省から開発を要請された品目について、開発の拒否、合理的
な理由のない開発の遅延等、適切に対応を行わなかった企業以外の企業とす
る。
(3)薬価の改定方式
(1)に該当する品目については、(2)に掲げる企業が製造販売するも
のに限り、本規定の適用前の価格に、別表 11 に定める額を加えた額に改定す
る。
2
控除
これまで新薬創出等加算を受けたことのある既収載品について、初めて次の
要件のいずれかに該当した場合は、これまで受けた新薬創出等加算の累積額を
本規定の適用前の価格から控除する。
イ 当該既収載品に係る後発品が薬価収載されていること
ロ 薬価収載の日から 15 年を経過していること
ハ 第2章第3部5の規定により薬価算定されることとなる配合剤(補正加算
の対象とならないものに限る。)に相当すると認められるものについては、
39