よむ、つかう、まなぶ。
参考資料1:一般用新型コロナウイルス抗原定性検査キットに係る製造販売承認申請の取扱いについて(令和4年8月17日付け薬生機審発0817第2号厚生労働省医薬・生活衛生局医療機器審査管理課長通知) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29413.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第8回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添
一般用 SARS コロナウイルス抗原キットに係る一般用検査薬ガイドライン
一般用 SARS コロナウイルス抗原キットに係る一般用検査薬の製造販売にあたっては、以下
の条件を満たす必要があること。
1.一般的名称
一般用 SARS コロナウイルス抗原キット
2.一般的名称の定義
生体由来の試料を用いて、SARS コロナウイルス抗原の検出を目的としたキット。使用者
が自ら検体を採取し、SARS-CoV-2 感染疑いの判定補助として使用されるもの。
3.使用目的
鼻腔ぬぐい液又は唾液中の SARS-CoV-2 抗原の検出(SARS-CoV-2 感染疑いの判定補助)
4.測定方法
(1)測定原理
イムノクロマト法によるものとする。
(2)操作方法
使用者が自ら必要に応じてキット付属の綿棒等を用いて鼻腔ぬぐい液又は唾液を採取し、
簡便に検査を行うことができるものとする。
(3)判定方法
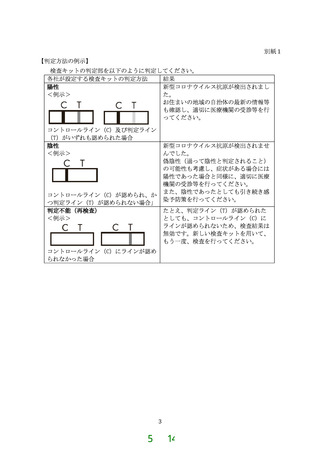
検査キットにおける判定部のラインの有無により目視判定するものとし、別紙1の例示
又はこれに類する方法によるものとする。
5.検出性能
既に製造販売承認された体外診断用医薬品(一般的名称としては「SARS コロナウイルス
抗原キット」)と同等の検出性能を有するものとする。
6.安定性
室温において安定性が確認されているものとする。
7.添付文書
添付文書は、別紙2の内容と同等のものとする。
8.説明事項等
販売時の使用者への情報提供等として、別紙3-1及び別紙3-2の内容と同等の説明
資料等を用いるとともに、製造販売業者又は販売業者から販売者に対して、必要に応じて
1
3 / 14
一般用 SARS コロナウイルス抗原キットに係る一般用検査薬ガイドライン
一般用 SARS コロナウイルス抗原キットに係る一般用検査薬の製造販売にあたっては、以下
の条件を満たす必要があること。
1.一般的名称
一般用 SARS コロナウイルス抗原キット
2.一般的名称の定義
生体由来の試料を用いて、SARS コロナウイルス抗原の検出を目的としたキット。使用者
が自ら検体を採取し、SARS-CoV-2 感染疑いの判定補助として使用されるもの。
3.使用目的
鼻腔ぬぐい液又は唾液中の SARS-CoV-2 抗原の検出(SARS-CoV-2 感染疑いの判定補助)
4.測定方法
(1)測定原理
イムノクロマト法によるものとする。
(2)操作方法
使用者が自ら必要に応じてキット付属の綿棒等を用いて鼻腔ぬぐい液又は唾液を採取し、
簡便に検査を行うことができるものとする。
(3)判定方法
検査キットにおける判定部のラインの有無により目視判定するものとし、別紙1の例示
又はこれに類する方法によるものとする。
5.検出性能
既に製造販売承認された体外診断用医薬品(一般的名称としては「SARS コロナウイルス
抗原キット」)と同等の検出性能を有するものとする。
6.安定性
室温において安定性が確認されているものとする。
7.添付文書
添付文書は、別紙2の内容と同等のものとする。
8.説明事項等
販売時の使用者への情報提供等として、別紙3-1及び別紙3-2の内容と同等の説明
資料等を用いるとともに、製造販売業者又は販売業者から販売者に対して、必要に応じて
1
3 / 14