よむ、つかう、まなぶ。
総-3○先進医療会議からの報告について (9 ページ)
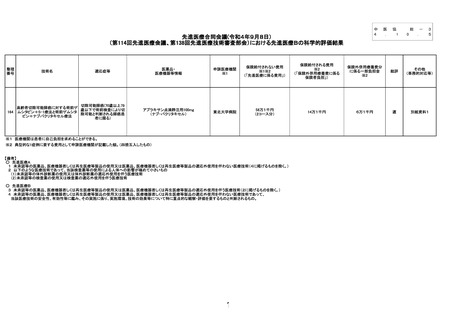
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00161.html |
| 出典情報 | 中央社会保険医療協議会 総会(第529回 10/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
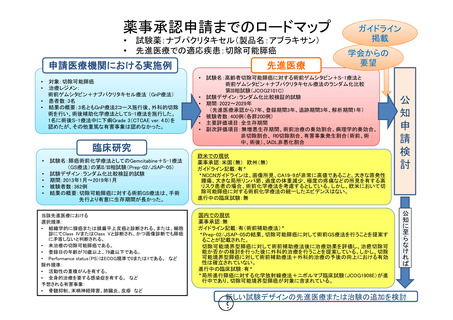
薬事承認申請までのロードマップ
•
•
試験薬:ナブパクリタキセル(製品名:アブラキサン)
先進医療での適応疾患:切除可能膵癌
先進医療
申請医療機関における実施例
•
•
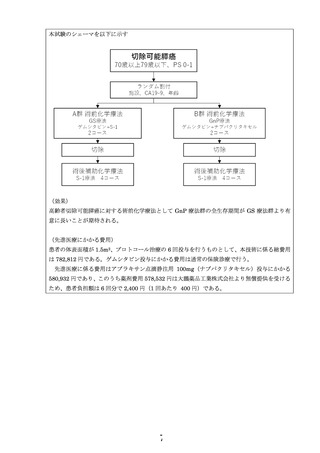
対象:切除可能膵癌
治療レジメン:
術前ゲムシタビン+ナブパクリタキセル療法 (GnP療法)
• 患者数:3名
• 結果の概要:3名ともGnP療法2コース施行後、外科的切除
術を行い、術後補助化学療法としてS-1療法を施行した。
1名に術後S-1療法中に下痢Grade 3(CTCAE ver. 4.0)を
認めたが、その他重篤な有害事象は認めなかった。
臨床研究
•
•
•
•
•
試験名:膵癌術前化学療法としてのGemcitabine+S-1療法
(GS療法)の第II/III相試験(Prep-02/JSAP-05)
試験デザイン:ランダム化比較検証的試験
期間:2013年1月~2019年1月
被験者数:362例
結果の概要:切除可能膵癌に対する術前GS療法は、手術
先行より有意に生存期間が長かった。
•
•
•
•
•
学会からの
要望
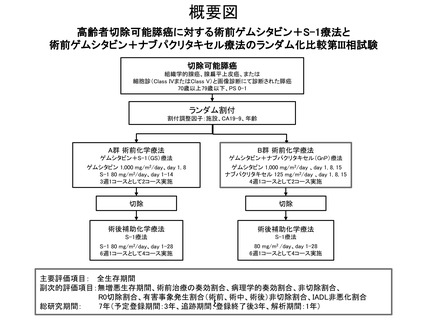
試験名:高齢者切除可能膵癌に対する術前ゲムシタビン+S-1療法と
術前ゲムシタビン+ナブパクリタキセル療法のランダム化比較
第III相試験(JCOG2101C)
試験デザイン:ランダム化比較検証的試験
期間:2022~2029年
(先進医療承認から7年、登録期間3年、追跡期間3年、解析期間1年)
被験者数:400例(各群200例)
主要評価項目:全生存期間
副次評価項目:無増悪生存期間、術前治療の奏効割合、病理学的奏効合、
非切除割合、 R0切除割合、有害事象発生割合(術前、術
中、術後)、IADL非悪化割合
欧米での現状
薬事承認:米国(無) 欧州(無)
ガイドライン記載:有*
*NCCNガイドラインは、画像所見、CA19-9が非常に高値であること、大きな原発性
腫瘍、大きな局所リンパ節、過度の体重減少、極度の疼痛などの所見を有する高
リスク患者の場合、術前化学療法を考慮するとしている。しかし、欧米において切
除可能膵癌に対する術前化学療法の統一したエビデンスはない。
進行中の臨床試験:無
国内での現状
薬事承認:無
ガイドライン記載:有(術前補助療法)*
*Prep-02/JSAP-05の結果、切除可能膵癌に対して術前GS療法を行うことを提案す
ることが記載された。
切除可能境界型膵癌に対して術前補助療法後に治療効果を評価し、治癒切除可
能か否かの検討を行った後に外科的治療を行うことを提案している。しかし、切除
可能境界型膵癌に対して術前補助療法+外科的治療の予後の向上における有効
性は確立されていない。
進行中の臨床試験:有*
*局所進行膵癌に対する化学放射線療法+ニボルマブ臨床試験(JCOG1908E)が進
行中であり、切除可能境界型膵癌が対象に含まれている。
公
知
申
請
検
討
公知に至らなければ
当該先進医療における
選択規準:
• 組織学的に腺癌または腺扁平上皮癌と診断される。または、細胞
診にてClass IVまたはClass Vと診断され、かつ画像診断でも膵癌
に矛盾しないと判断される。
• 未治療の切除可能膵癌である。
• 登録日の年齢が70歳以上、79歳以下である。
• Performance status(PS)はECOG規準で0または1である。 など
除外規準:
• 活動性の重複がんを有する。
• 全身的治療を要する感染症を有する。 など
予想される有害事象:
• 骨髄抑制、末梢神経障害、肺臓炎、皮疹 など
•
ガイドライン
掲載
新しい試験デザインの先進医療または治験の追加を検討
9
•
•
試験薬:ナブパクリタキセル(製品名:アブラキサン)
先進医療での適応疾患:切除可能膵癌
先進医療
申請医療機関における実施例
•
•
対象:切除可能膵癌
治療レジメン:
術前ゲムシタビン+ナブパクリタキセル療法 (GnP療法)
• 患者数:3名
• 結果の概要:3名ともGnP療法2コース施行後、外科的切除
術を行い、術後補助化学療法としてS-1療法を施行した。
1名に術後S-1療法中に下痢Grade 3(CTCAE ver. 4.0)を
認めたが、その他重篤な有害事象は認めなかった。
臨床研究
•
•
•
•
•
試験名:膵癌術前化学療法としてのGemcitabine+S-1療法
(GS療法)の第II/III相試験(Prep-02/JSAP-05)
試験デザイン:ランダム化比較検証的試験
期間:2013年1月~2019年1月
被験者数:362例
結果の概要:切除可能膵癌に対する術前GS療法は、手術
先行より有意に生存期間が長かった。
•
•
•
•
•
学会からの
要望
試験名:高齢者切除可能膵癌に対する術前ゲムシタビン+S-1療法と
術前ゲムシタビン+ナブパクリタキセル療法のランダム化比較
第III相試験(JCOG2101C)
試験デザイン:ランダム化比較検証的試験
期間:2022~2029年
(先進医療承認から7年、登録期間3年、追跡期間3年、解析期間1年)
被験者数:400例(各群200例)
主要評価項目:全生存期間
副次評価項目:無増悪生存期間、術前治療の奏効割合、病理学的奏効合、
非切除割合、 R0切除割合、有害事象発生割合(術前、術
中、術後)、IADL非悪化割合
欧米での現状
薬事承認:米国(無) 欧州(無)
ガイドライン記載:有*
*NCCNガイドラインは、画像所見、CA19-9が非常に高値であること、大きな原発性
腫瘍、大きな局所リンパ節、過度の体重減少、極度の疼痛などの所見を有する高
リスク患者の場合、術前化学療法を考慮するとしている。しかし、欧米において切
除可能膵癌に対する術前化学療法の統一したエビデンスはない。
進行中の臨床試験:無
国内での現状
薬事承認:無
ガイドライン記載:有(術前補助療法)*
*Prep-02/JSAP-05の結果、切除可能膵癌に対して術前GS療法を行うことを提案す
ることが記載された。
切除可能境界型膵癌に対して術前補助療法後に治療効果を評価し、治癒切除可
能か否かの検討を行った後に外科的治療を行うことを提案している。しかし、切除
可能境界型膵癌に対して術前補助療法+外科的治療の予後の向上における有効
性は確立されていない。
進行中の臨床試験:有*
*局所進行膵癌に対する化学放射線療法+ニボルマブ臨床試験(JCOG1908E)が進
行中であり、切除可能境界型膵癌が対象に含まれている。
公
知
申
請
検
討
公知に至らなければ
当該先進医療における
選択規準:
• 組織学的に腺癌または腺扁平上皮癌と診断される。または、細胞
診にてClass IVまたはClass Vと診断され、かつ画像診断でも膵癌
に矛盾しないと判断される。
• 未治療の切除可能膵癌である。
• 登録日の年齢が70歳以上、79歳以下である。
• Performance status(PS)はECOG規準で0または1である。 など
除外規準:
• 活動性の重複がんを有する。
• 全身的治療を要する感染症を有する。 など
予想される有害事象:
• 骨髄抑制、末梢神経障害、肺臓炎、皮疹 など
•
ガイドライン
掲載
新しい試験デザインの先進医療または治験の追加を検討
9