よむ、つかう、まなぶ。
○再生医療等製品の医療保険上の取扱いについて-1 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00136.html |
| 出典情報 | 中央社会保険医療協議会 総会(第513回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
再生医療等製品の取扱いについて
類別
ヒト細胞加工製品(ヒト体細胞加工製品)
一般的名称
イデカブタゲン ビクルユーセル
収載希望者
ブリストル・マイヤーズ スクイブ(株)
販売名
形状、成分、
分量等
承認区分
効能、効果
又は性能
用法及び用量
又は使用方法
アベクマ点滴静注
患者の白血球アフェレーシス産物から選別した末梢血 T 細胞に、遺伝子組
換えレンチウイルスベクターを用いて、B 細胞成熟抗原(BCMA)を標的と
するキメラ抗原受容体(CAR)をコードする遺伝子を導入した再生医療等製
品
新再生医療等製品(希少疾病用再生医療等製品)
再発又は難治性の多発性骨髄腫。ただし、以下のいずれも満たす場合に限る。
・BCMA 抗原を標的としたキメラ抗原受容体発現 T 細胞輸注療法の治療歴がない
・免疫調節薬、プロテアソーム阻害剤及び抗 CD38 モノクローナル抗体製剤を含
む 3 つ以上の前治療歴を有し、かつ、直近の前治療に対して病勢進行が認め
られた又は治療後に再発した
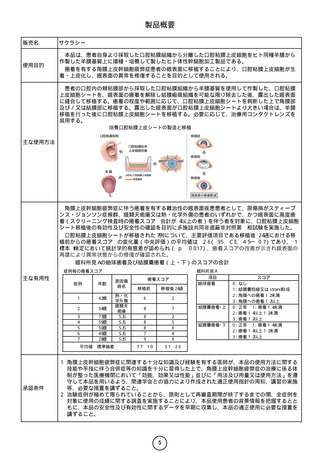
<医療機関での白血球アフェレーシス〜製造施設への輸送>
1. 白血球アフェレーシス
白血球アフェレーシスにより、非動員末梢血単核球を採取する。
2. 白血球アフェレーシス産物の輸送
採取した白血球アフェレーシス産物を、2〜8℃に設定された保冷輸送箱に梱
包して本品製造施設へ輸送する。
<医療機関での受入れ〜投与>
3. 本品の受領及び保存
凍結した状態で本品を受領し、使用直前まで液体窒素気相下(−130℃以下)
で凍結保存する。
4. 投与前の前処置
血液検査等により患者の状態を確認し、本品投与の5日前から以下のリンパ球
除去化学療法を行う。
シクロホスファミド(無水物換算)として300mg/m2を1日1回3日間点滴静注
及びフルダラビンリン酸エステルとして30mg/m2を1日1回3日間点滴静注する。
なお、患者の状態(腎機能障害等)により適宜減量する。
5. 本品の投与
投与直前に本品を解凍する。通常、成人には、CAR発現T細胞として、体重を
問わず目標投与数450×106個を、10mL/分を超えない速度で単回静脈内投与す
る。なお、CAR発現T細胞として280×106〜540×106個の範囲で投与できる。
本品の再投与はしないこと。
医療保険上の取扱い(案)
本品目については、審査報告書において、「医薬品と同様に薬理的作用による治療
効果を期待して、静脈内に投与される再生医療等製品」とされており、また、静脈内
に点滴で投与する点も医薬品のような投与法であることから、医薬品の例により対応
することとし、薬価算定組織において償還価格について検討し、中央社会保険医療協
議会総会において薬価基準への収載について審議することとしてはどうか。
2
類別
ヒト細胞加工製品(ヒト体細胞加工製品)
一般的名称
イデカブタゲン ビクルユーセル
収載希望者
ブリストル・マイヤーズ スクイブ(株)
販売名
形状、成分、
分量等
承認区分
効能、効果
又は性能
用法及び用量
又は使用方法
アベクマ点滴静注
患者の白血球アフェレーシス産物から選別した末梢血 T 細胞に、遺伝子組
換えレンチウイルスベクターを用いて、B 細胞成熟抗原(BCMA)を標的と
するキメラ抗原受容体(CAR)をコードする遺伝子を導入した再生医療等製
品
新再生医療等製品(希少疾病用再生医療等製品)
再発又は難治性の多発性骨髄腫。ただし、以下のいずれも満たす場合に限る。
・BCMA 抗原を標的としたキメラ抗原受容体発現 T 細胞輸注療法の治療歴がない
・免疫調節薬、プロテアソーム阻害剤及び抗 CD38 モノクローナル抗体製剤を含
む 3 つ以上の前治療歴を有し、かつ、直近の前治療に対して病勢進行が認め
られた又は治療後に再発した
<医療機関での白血球アフェレーシス〜製造施設への輸送>
1. 白血球アフェレーシス
白血球アフェレーシスにより、非動員末梢血単核球を採取する。
2. 白血球アフェレーシス産物の輸送
採取した白血球アフェレーシス産物を、2〜8℃に設定された保冷輸送箱に梱
包して本品製造施設へ輸送する。
<医療機関での受入れ〜投与>
3. 本品の受領及び保存
凍結した状態で本品を受領し、使用直前まで液体窒素気相下(−130℃以下)
で凍結保存する。
4. 投与前の前処置
血液検査等により患者の状態を確認し、本品投与の5日前から以下のリンパ球
除去化学療法を行う。
シクロホスファミド(無水物換算)として300mg/m2を1日1回3日間点滴静注
及びフルダラビンリン酸エステルとして30mg/m2を1日1回3日間点滴静注する。
なお、患者の状態(腎機能障害等)により適宜減量する。
5. 本品の投与
投与直前に本品を解凍する。通常、成人には、CAR発現T細胞として、体重を
問わず目標投与数450×106個を、10mL/分を超えない速度で単回静脈内投与す
る。なお、CAR発現T細胞として280×106〜540×106個の範囲で投与できる。
本品の再投与はしないこと。
医療保険上の取扱い(案)
本品目については、審査報告書において、「医薬品と同様に薬理的作用による治療
効果を期待して、静脈内に投与される再生医療等製品」とされており、また、静脈内
に点滴で投与する点も医薬品のような投与法であることから、医薬品の例により対応
することとし、薬価算定組織において償還価格について検討し、中央社会保険医療協
議会総会において薬価基準への収載について審議することとしてはどうか。
2