よむ、つかう、まなぶ。
参考資料7 ヒト受精胚に遺伝情報改変技術等を用いる研究に関する倫理指針(令和4年3月 31 日最終改正) (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27228.html |
| 出典情報 | ヒト受精胚等へのゲノム編集技術等を用いる研究に関する合同会議(再設置第2回 8/3)《厚生労働省》《文部科学省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
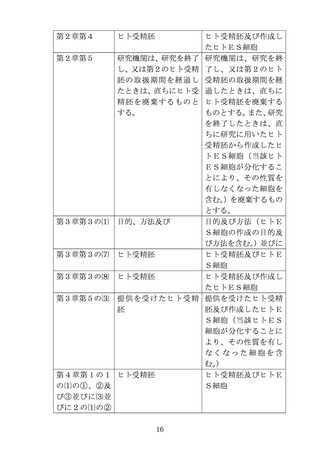
究計画の実施について、提供機関の長の了解を得るものとする。た
だし、研究機関と提供機関が同一である場合には、この限りでな
い。
⑷ 提供機関の長は、⑶の研究計画の実施を了解するに当たっては、
提供機関の倫理審査委員会の意見を聴くものとする。なお、提供機
関の長は、研究計画の実施を了解する場合には、提供機関の倫理審
査委員会における審査の過程及び結果を示す書類を添えて、研究機
関の長に通知するものとする。
2 文部科学大臣及び厚生労働大臣の確認等
⑴ 研究機関の長は、研究計画の実施を了承するに当たっては、研究
計画のこの指針に対する適合性について文部科学大臣及び厚生労働
大臣の確認を受けるものとする。
⑵ 研究機関の長は、⑴の確認を求めるに当たって、次に掲げる書類
を提出するものとする。
① 研究計画書
② 研究機関のヒト受精胚の取扱いに関する規則の写し
③ 研究機関の倫理審査委員会における審査の過程及び結果を示す
書類並びに倫理審査委員会に関する事項を記載した書類
④ 提供機関のヒト受精胚の保存に関する規則の写し
⑤ 提供機関の倫理審査委員会における審査の過程及び結果を示す
書類並びに当該機関の倫理審査委員会に関する事項を記載した書
類
3 研究計画書
研究計画書には、次に掲げる事項を記載するものとする。
⑴ 研究計画の名称
⑵ 研究機関の名称及びその所在地並びに研究機関の長の氏名
⑶ 研究責任者の氏名、略歴、研究業績、教育研修の受講歴及び研究に
おいて果たす役割
⑷ 研究実施者の氏名、略歴、研究業績、教育研修の受講歴及び研究に
おいて果たす役割
⑸ 研究に用いられるヒト受精胚及びその入手方法
⑹ 研究の目的及び必要性
⑺ 研究の方法(研究に用いる遺伝情報改変技術等の種類を含む。
)及
び期間
⑻ 研究機関の基準に関する説明
⑼ インフォームド・コンセントに関する説明
12
だし、研究機関と提供機関が同一である場合には、この限りでな
い。
⑷ 提供機関の長は、⑶の研究計画の実施を了解するに当たっては、
提供機関の倫理審査委員会の意見を聴くものとする。なお、提供機
関の長は、研究計画の実施を了解する場合には、提供機関の倫理審
査委員会における審査の過程及び結果を示す書類を添えて、研究機
関の長に通知するものとする。
2 文部科学大臣及び厚生労働大臣の確認等
⑴ 研究機関の長は、研究計画の実施を了承するに当たっては、研究
計画のこの指針に対する適合性について文部科学大臣及び厚生労働
大臣の確認を受けるものとする。
⑵ 研究機関の長は、⑴の確認を求めるに当たって、次に掲げる書類
を提出するものとする。
① 研究計画書
② 研究機関のヒト受精胚の取扱いに関する規則の写し
③ 研究機関の倫理審査委員会における審査の過程及び結果を示す
書類並びに倫理審査委員会に関する事項を記載した書類
④ 提供機関のヒト受精胚の保存に関する規則の写し
⑤ 提供機関の倫理審査委員会における審査の過程及び結果を示す
書類並びに当該機関の倫理審査委員会に関する事項を記載した書
類
3 研究計画書
研究計画書には、次に掲げる事項を記載するものとする。
⑴ 研究計画の名称
⑵ 研究機関の名称及びその所在地並びに研究機関の長の氏名
⑶ 研究責任者の氏名、略歴、研究業績、教育研修の受講歴及び研究に
おいて果たす役割
⑷ 研究実施者の氏名、略歴、研究業績、教育研修の受講歴及び研究に
おいて果たす役割
⑸ 研究に用いられるヒト受精胚及びその入手方法
⑹ 研究の目的及び必要性
⑺ 研究の方法(研究に用いる遺伝情報改変技術等の種類を含む。
)及
び期間
⑻ 研究機関の基準に関する説明
⑼ インフォームド・コンセントに関する説明
12