よむ、つかう、まなぶ。
【参考資料2-1】医薬品の品質確保に関する取り組み(指摘事例の公表)(医薬・生活衛生局からの参考資料) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26381.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第8回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
■ PMDA医薬品品質管理部
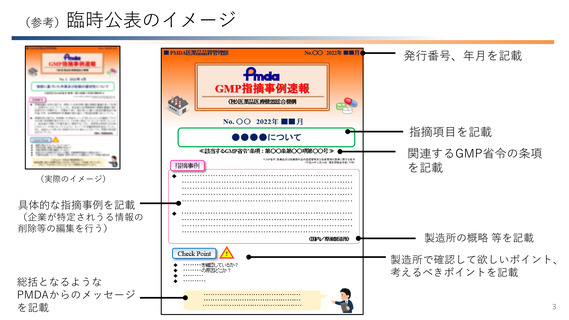
No. 1 2022年 4月
GMP指摘事例速報
< ORANGE* Letter >
(独)医薬品医療機器総合機構
* Observed Regulatory Attention / Notification of GMP Elements
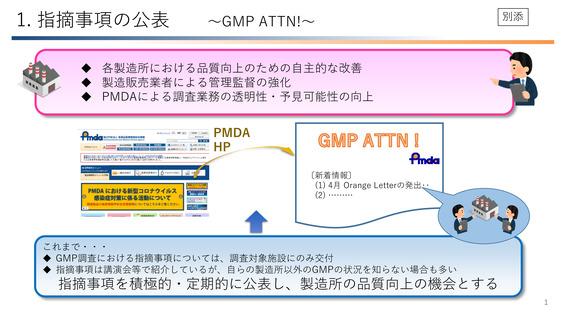
医薬品の原料が適正であることの確認の重要性について
≪関連するGMP省令**条項 :第十条第五号≫
** GMP省令:医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令
(平成16年12月24日 厚生労働省令第179号)
指摘事例
原料の受入時に供給元の確認を適切に行わなかった事例
<背景>
GMP省令では、原料について、ロットごとに適正である旨を確認し、
その結果に関する記録を作成することを要求。
当該製造所の手順では、原料の受入時に、容器に貼付されたラベルにより、
供給元のメーカー名を確認し、その記録を残すことを規定。
試験成績書のメーカー名で
確認できるから、いいかな…
試験
成績書
原料A
・・・・
<確認された事例>
メーカー名??
原料Aの容器に貼付されたラベルには、メーカー名が未記載。
しかし、受入記録では、容器に貼付されたラベルにより、メーカー名を確認したように記録。
実際には、受入担当者は容器に貼付されたラベルを直接確認せず、原料Aの試験成績書により、
メーカー名を確認。
<問題点・リスク>
容器に貼付されたラベルの確認を怠った場合、本来入荷すべき原料と異なる原料が入荷されたとして
も、検知できないリスクが存在。
本来入荷すべき原料と異なる原料を使用した場合、当該原料を使用した製品の品質に、重大な影響を
及ぼす危険性が存在。
(国内/原薬製造所)
Check Point
!
手順どおりにラベルの確認、記録を行っているか(行っていない場合、原因調査、適切な改善、影響評価が必要)
作業者は、自らが行っている業務の意味(ラベルの確認を徹底する意味)を理解しているか
製造所全体に、手順を遵守する意識(コンプライアンス)が浸透しているか
あなたの、その一つの “ カクニン ”が、品質を創る!!
近年、原料の取り違えにより、経口抗真菌剤に睡眠導入剤が混入し、服用した患者が死亡する事案が発生。
原料の取り違えのリスク低減のため、原料の受入~製造工程での仕込みまでの間、複数部署によるラベルの確認
等を経ることが必要。一方、ラベルの表示内容や入荷した原料がそもそも適正でなければ、こうしたリスク低減策は
その意義を喪失。
従って、原料の受入れ時に、ラベルの表示内容を徹底して確認することは極めて重要であり、原料の取り違え防止
のための基本中の基本!
原料の受入
確
認
倉庫からの払い出し
確
認
製造部門による受入
確
認
製造工程での仕込み
確
認
No. 1 2022年 4月
GMP指摘事例速報
< ORANGE* Letter >
(独)医薬品医療機器総合機構
* Observed Regulatory Attention / Notification of GMP Elements
医薬品の原料が適正であることの確認の重要性について
≪関連するGMP省令**条項 :第十条第五号≫
** GMP省令:医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令
(平成16年12月24日 厚生労働省令第179号)
指摘事例
原料の受入時に供給元の確認を適切に行わなかった事例
<背景>
GMP省令では、原料について、ロットごとに適正である旨を確認し、
その結果に関する記録を作成することを要求。
当該製造所の手順では、原料の受入時に、容器に貼付されたラベルにより、
供給元のメーカー名を確認し、その記録を残すことを規定。
試験成績書のメーカー名で
確認できるから、いいかな…
試験
成績書
原料A
・・・・
<確認された事例>
メーカー名??
原料Aの容器に貼付されたラベルには、メーカー名が未記載。
しかし、受入記録では、容器に貼付されたラベルにより、メーカー名を確認したように記録。
実際には、受入担当者は容器に貼付されたラベルを直接確認せず、原料Aの試験成績書により、
メーカー名を確認。
<問題点・リスク>
容器に貼付されたラベルの確認を怠った場合、本来入荷すべき原料と異なる原料が入荷されたとして
も、検知できないリスクが存在。
本来入荷すべき原料と異なる原料を使用した場合、当該原料を使用した製品の品質に、重大な影響を
及ぼす危険性が存在。
(国内/原薬製造所)
Check Point
!
手順どおりにラベルの確認、記録を行っているか(行っていない場合、原因調査、適切な改善、影響評価が必要)
作業者は、自らが行っている業務の意味(ラベルの確認を徹底する意味)を理解しているか
製造所全体に、手順を遵守する意識(コンプライアンス)が浸透しているか
あなたの、その一つの “ カクニン ”が、品質を創る!!
近年、原料の取り違えにより、経口抗真菌剤に睡眠導入剤が混入し、服用した患者が死亡する事案が発生。
原料の取り違えのリスク低減のため、原料の受入~製造工程での仕込みまでの間、複数部署によるラベルの確認
等を経ることが必要。一方、ラベルの表示内容や入荷した原料がそもそも適正でなければ、こうしたリスク低減策は
その意義を喪失。
従って、原料の受入れ時に、ラベルの表示内容を徹底して確認することは極めて重要であり、原料の取り違え防止
のための基本中の基本!
原料の受入
確
認
倉庫からの払い出し
確
認
製造部門による受入
確
認
製造工程での仕込み
確
認