よむ、つかう、まなぶ。
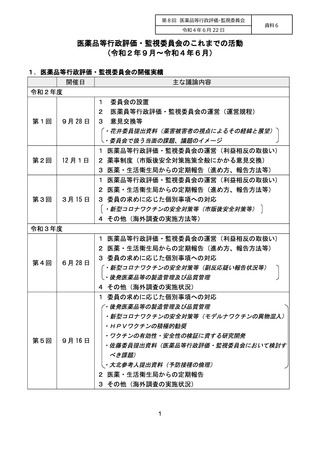
【資料6】医薬品等行政評価・監視委員会のこれまでの活動(令和2年9月~令和4年6月) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26381.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第8回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.定期報告、海外調査
(1)医薬・生活衛生局からの定期報告
【報告方針(報告対象、報告内容等)】
4.(3)の委員会決定のとおり
【報告内容】 ※[ ]は報告回。
① 製造販売承認された新医薬品の情報[第5回、第6回、第7回、第8回]
② 国内における市販後安全対策の措置状況[第6回、第8回]
③ 外国での安全対策措置及び国内での対応状況[第6回、第8回]
(2)医薬品等行政評価・監視委員会における海外調査
【調査実施方針】
・ 令和3年度の医薬品等行政評価・監視委員会における海外調査
・ 医薬品等行政評価・監視委員会における海外調査(令和4年度)について(案)
第8回医薬品等行政評価・監視委員会 資料5-2 を参照。
【調査内容】 ※[ ]は報告回。
① 個別医薬品の欧米での承認状況等[第5回~第8回]
a 先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
b 条件付き早期承認制度の対象品目
c 審査報告書の作成時点において、米国及び欧州で未承認であった品目
d 特例承認を受けた品目
② 欧米の薬事制度
・令和3年度[第7回]
ア 市販後における医薬品の副作用情報収集及び評価のシステム
(日米欧における副作用情報の報告対象範囲の比較を含む)
イ 市販後安全対策に関連する安全性の評価及び措置の検討を行う会議体
(具体的な議題や内容の最近の例を含む)
ウ 医薬品リスク管理計画(RMP)及びそれに準ずる制度
(日米欧における制度の比較を含む)
4.委員会決定
(1)医薬品等行政評価・監視委員会運営規程(令和2年9月 28 日)
(2)医薬品等行政評価・監視委員会における利益相反の取扱い規程(令和3年7月 19 日)
(3)「医薬・生活衛生局からの定期報告」の報告対象等について(令和3年7月 19 日)
3
(1)医薬・生活衛生局からの定期報告
【報告方針(報告対象、報告内容等)】
4.(3)の委員会決定のとおり
【報告内容】 ※[ ]は報告回。
① 製造販売承認された新医薬品の情報[第5回、第6回、第7回、第8回]
② 国内における市販後安全対策の措置状況[第6回、第8回]
③ 外国での安全対策措置及び国内での対応状況[第6回、第8回]
(2)医薬品等行政評価・監視委員会における海外調査
【調査実施方針】
・ 令和3年度の医薬品等行政評価・監視委員会における海外調査
・ 医薬品等行政評価・監視委員会における海外調査(令和4年度)について(案)
第8回医薬品等行政評価・監視委員会 資料5-2 を参照。
【調査内容】 ※[ ]は報告回。
① 個別医薬品の欧米での承認状況等[第5回~第8回]
a 先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
b 条件付き早期承認制度の対象品目
c 審査報告書の作成時点において、米国及び欧州で未承認であった品目
d 特例承認を受けた品目
② 欧米の薬事制度
・令和3年度[第7回]
ア 市販後における医薬品の副作用情報収集及び評価のシステム
(日米欧における副作用情報の報告対象範囲の比較を含む)
イ 市販後安全対策に関連する安全性の評価及び措置の検討を行う会議体
(具体的な議題や内容の最近の例を含む)
ウ 医薬品リスク管理計画(RMP)及びそれに準ずる制度
(日米欧における制度の比較を含む)
4.委員会決定
(1)医薬品等行政評価・監視委員会運営規程(令和2年9月 28 日)
(2)医薬品等行政評価・監視委員会における利益相反の取扱い規程(令和3年7月 19 日)
(3)「医薬・生活衛生局からの定期報告」の報告対象等について(令和3年7月 19 日)
3