よむ、つかう、まなぶ。
資料2-5 医療上の必要性に関する専門作業班(WG)の評価 抗菌・抗炎症WG[281KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00045.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第67回 2/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
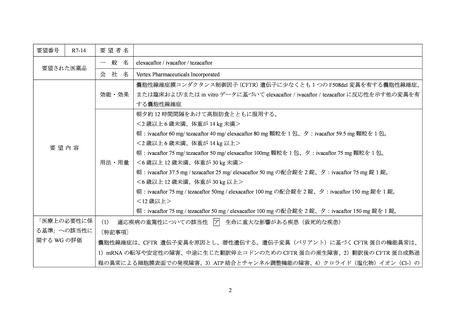
要望番号
R7-14
要望された医薬品
要望者名
一
般
名
elexacaftor / ivacaftor / tezacaftor
会
社
名
Vertex Pharmaceuticals Incorporated
嚢胞性線維症膜コンダクタンス制御因子(CFTR)遺伝子に少なくとも 1 つの F508del 変異を有する嚢胞性線維症、
効能・効果
または臨床および/または in vitro データに基づいて elexacaftor / ivacaftor / tezacaftor に反応性を示す他の変異を有
する嚢胞性線維症
朝夕約 12 時間間隔をあけて高脂肪食とともに服用する。
<2 歳以上 6 歳未満、体重が 14 kg 未満>
朝:ivacaftor 60 mg/ tezacaftor 40 mg/ elexacaftor 80 mg 顆粒を 1 包、夕:ivacaftor 59.5 mg 顆粒を 1 包。
<2 歳以上 6 歳未満、体重が 14 kg 以上>
要望内容
朝:ivacaftor 75 mg/ tezacaftor 50 mg/ elexacaftor 100mg 顆粒を 1 包、夕:ivacaftor 75 mg 顆粒を 1 包。
用法・用量
<6 歳以上 12 歳未満、体重が 30 kg 未満>
朝:ivacaftor 37.5 mg / tezacaftor 25 mg/ elexacaftor 50 mg の配合錠を 2 錠、夕:ivacaftor 75 mg 錠 1 錠。
<6 歳以上 12 歳未満、体重が 30 kg 以上>
朝:ivacaftor 75 mg / tezacaftor 50mg / elexacaftor 100 mg の配合錠を 2 錠、夕:ivacaftor 150 mg 錠を 1 錠。
<12 歳以上>
朝:ivacaftor 75 mg / tezacaftor 50 mg / elexacaftor 100 mg の配合錠を 2 錠、夕:ivacaftor 150 mg 錠を 1 錠。
「医療上の必要性に係 (1) 適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
生命に重大な影響がある疾患(致死的な疾患)
嚢胞性線維症は、CFTR 遺伝子変異を原因とし、潜性遺伝する。遺伝子変異(バリアント)に基づく CFTR 蛋白の機能異常は、
1)mRNA の転写や安定性の障害、中途に生じた翻訳停止コドンのための CFTR 蛋白の産生障害、2)翻訳後の CFTR 蛋白成熟過
程の異常による細胞膜表面での発現障害、3)ATP 結合とチャンネル調整機能の障害、4)クロライド(塩化物)イオン(Cl-)の
2
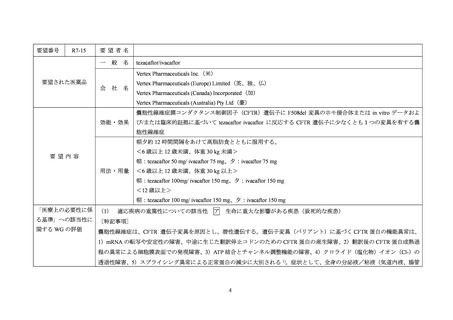
R7-14
要望された医薬品
要望者名
一
般
名
elexacaftor / ivacaftor / tezacaftor
会
社
名
Vertex Pharmaceuticals Incorporated
嚢胞性線維症膜コンダクタンス制御因子(CFTR)遺伝子に少なくとも 1 つの F508del 変異を有する嚢胞性線維症、
効能・効果
または臨床および/または in vitro データに基づいて elexacaftor / ivacaftor / tezacaftor に反応性を示す他の変異を有
する嚢胞性線維症
朝夕約 12 時間間隔をあけて高脂肪食とともに服用する。
<2 歳以上 6 歳未満、体重が 14 kg 未満>
朝:ivacaftor 60 mg/ tezacaftor 40 mg/ elexacaftor 80 mg 顆粒を 1 包、夕:ivacaftor 59.5 mg 顆粒を 1 包。
<2 歳以上 6 歳未満、体重が 14 kg 以上>
要望内容
朝:ivacaftor 75 mg/ tezacaftor 50 mg/ elexacaftor 100mg 顆粒を 1 包、夕:ivacaftor 75 mg 顆粒を 1 包。
用法・用量
<6 歳以上 12 歳未満、体重が 30 kg 未満>
朝:ivacaftor 37.5 mg / tezacaftor 25 mg/ elexacaftor 50 mg の配合錠を 2 錠、夕:ivacaftor 75 mg 錠 1 錠。
<6 歳以上 12 歳未満、体重が 30 kg 以上>
朝:ivacaftor 75 mg / tezacaftor 50mg / elexacaftor 100 mg の配合錠を 2 錠、夕:ivacaftor 150 mg 錠を 1 錠。
<12 歳以上>
朝:ivacaftor 75 mg / tezacaftor 50 mg / elexacaftor 100 mg の配合錠を 2 錠、夕:ivacaftor 150 mg 錠を 1 錠。
「医療上の必要性に係 (1) 適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
生命に重大な影響がある疾患(致死的な疾患)
嚢胞性線維症は、CFTR 遺伝子変異を原因とし、潜性遺伝する。遺伝子変異(バリアント)に基づく CFTR 蛋白の機能異常は、
1)mRNA の転写や安定性の障害、中途に生じた翻訳停止コドンのための CFTR 蛋白の産生障害、2)翻訳後の CFTR 蛋白成熟過
程の異常による細胞膜表面での発現障害、3)ATP 結合とチャンネル調整機能の障害、4)クロライド(塩化物)イオン(Cl-)の
2