よむ、つかう、まなぶ。
参考資料 12 定期の予防接種等による副反応疑いの報告等の取扱いについて(平成 25 年 3月 30 日付け健発 0330 第3号・薬食発 0330 第1号厚生労働省健康局長 及び医薬食品局長連名通知。最終改正:令和7年3月31日)[3.2MB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00170.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第110回 2/4)医薬品等安全対策部会安全対策調査会(令和7年度第11回 2/4)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
記
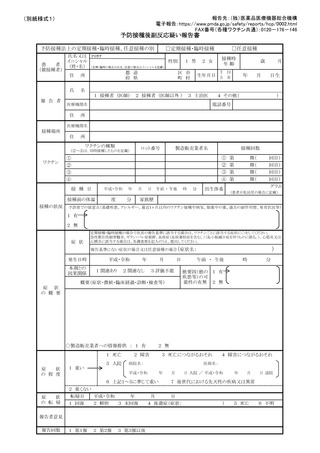
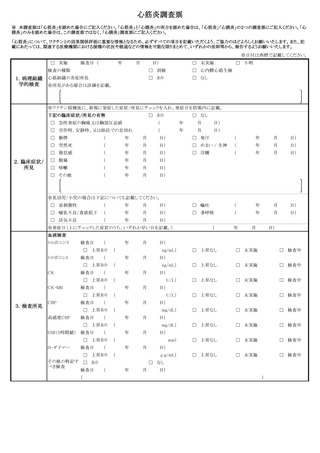
1 副反応疑い報告について
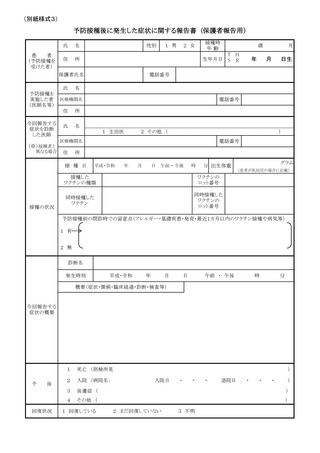
(1)市町村(特別区を含む。以下同じ。)は、あらかじめ別紙様式1並びに急性散在
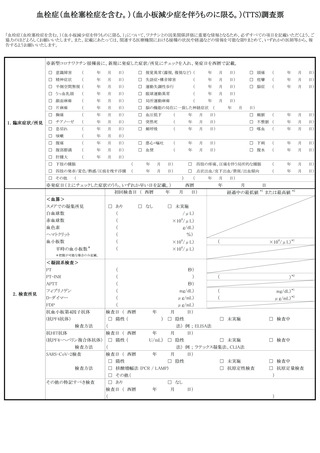
性脳脊髄炎(ADEM)調査票、ギラン・バレ症候群(GBS)調査票、血栓症(T
TS(血栓塞栓症を含み、血小板減少症を伴うものに限る。以下同じ。))調査票、
心筋炎調査票及び心膜炎調査票(以下「全種調査票」という。)を管内の医療機関
に周知し、医師等が予防接種法施行規則(昭和 23 年厚生省令第 36 号)第5条に
規定する症状(別紙様式1の報告基準参照)を診断した場合には、速やかに電子報
告
シ
ス
テ
ム
(
別
添
1
、
報
告
受
付
サ
イ
ト
URL
:
https://www.pmda.go.jp/safety/reports/hcp/0002.html)にて機構へ報告するよう周知す
ること。なお、電子的な報告が困難な場合は予防接種の種類に関わらず FAX(FAX 番
号:0120-176-146)にて報告を受け付けている。この報告は、患者に予防接種を行った
医師等以外の医師等も行うものとすること。FAX による報告の場合、別紙様式1又
は国立健康危機管理研究機構(以下「JIHS」という。)のホームページからダ
ウンロードできる予防接種後副反応疑い報告書入力アプリにて作成した別紙様式
2を使用して報告すること(記載事項の詳細については、別紙様式1記入要領を参
照すること)。また、いずれの手段による報告であっても、その症状が急性散在性
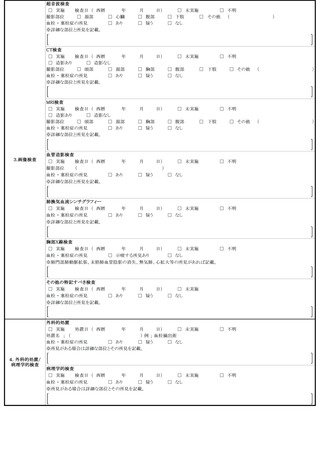
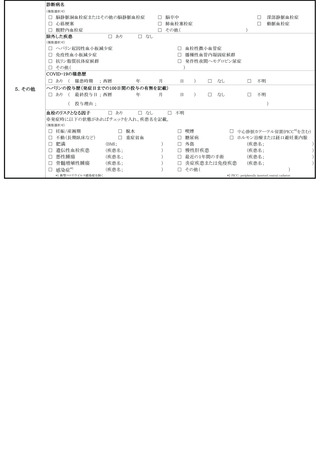
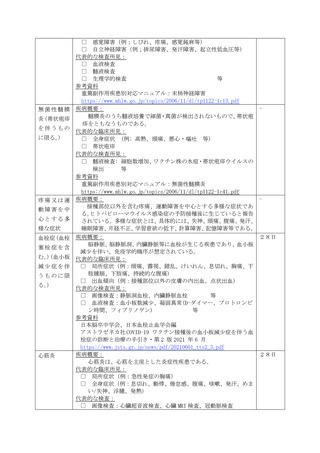
脳脊髄炎(ADEM)、ギラン・バレ症候群(GBS)、血栓症(TTS)、心筋
炎又は心膜炎と疑われる場合は、それぞれ急性散在性脳脊髄炎(ADEM)調査票、
ギラン・バレ症候群(GBS)調査票、血栓症(TTS)調査票、心筋炎調査票又
は心膜炎調査票を作成して報告するものとすること。なお、心筋炎及び心膜炎がと
もに疑われる場合にあっては、心筋炎調査票及び心膜炎調査票の両方を作成して報
告すること。各調査票の作成にあたっては、全ての項目について遺漏なく入力する
こと。また、報告対象となる症例の経過において複数の医師等が関与した場合にあ
っては、そのうち代表する者が、接種の状況や経過等の情報を可能な限り集約して
調査票に入力の上、報告することが望ましいこと。
(2)機構は、医師等から(1)の報告を受理した後、速やかに厚生労働省へ報告する
こと。
(3)厚生労働省は、機構から(1)の報告を受理した後、速やかに都道府県に当該報
告を情報提供するので、当該報告を受け取った都道府県は、速やかに予防接種を実
施した市町村に情報提供すること。
(4)(1)の報告を行った場合には、厚生労働省において、医薬品医療機器等法第 68
条の 10 第2項の規定による報告としても取り扱うこととするため、医師等は、重ね
て同項の規定による報告をする必要はないこと。
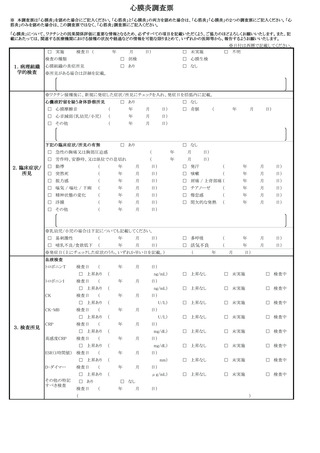
1 副反応疑い報告について
(1)市町村(特別区を含む。以下同じ。)は、あらかじめ別紙様式1並びに急性散在
性脳脊髄炎(ADEM)調査票、ギラン・バレ症候群(GBS)調査票、血栓症(T
TS(血栓塞栓症を含み、血小板減少症を伴うものに限る。以下同じ。))調査票、
心筋炎調査票及び心膜炎調査票(以下「全種調査票」という。)を管内の医療機関
に周知し、医師等が予防接種法施行規則(昭和 23 年厚生省令第 36 号)第5条に
規定する症状(別紙様式1の報告基準参照)を診断した場合には、速やかに電子報
告
シ
ス
テ
ム
(
別
添
1
、
報
告
受
付
サ
イ
ト
URL
:
https://www.pmda.go.jp/safety/reports/hcp/0002.html)にて機構へ報告するよう周知す
ること。なお、電子的な報告が困難な場合は予防接種の種類に関わらず FAX(FAX 番
号:0120-176-146)にて報告を受け付けている。この報告は、患者に予防接種を行った
医師等以外の医師等も行うものとすること。FAX による報告の場合、別紙様式1又
は国立健康危機管理研究機構(以下「JIHS」という。)のホームページからダ
ウンロードできる予防接種後副反応疑い報告書入力アプリにて作成した別紙様式
2を使用して報告すること(記載事項の詳細については、別紙様式1記入要領を参
照すること)。また、いずれの手段による報告であっても、その症状が急性散在性
脳脊髄炎(ADEM)、ギラン・バレ症候群(GBS)、血栓症(TTS)、心筋
炎又は心膜炎と疑われる場合は、それぞれ急性散在性脳脊髄炎(ADEM)調査票、
ギラン・バレ症候群(GBS)調査票、血栓症(TTS)調査票、心筋炎調査票又
は心膜炎調査票を作成して報告するものとすること。なお、心筋炎及び心膜炎がと
もに疑われる場合にあっては、心筋炎調査票及び心膜炎調査票の両方を作成して報
告すること。各調査票の作成にあたっては、全ての項目について遺漏なく入力する
こと。また、報告対象となる症例の経過において複数の医師等が関与した場合にあ
っては、そのうち代表する者が、接種の状況や経過等の情報を可能な限り集約して
調査票に入力の上、報告することが望ましいこと。
(2)機構は、医師等から(1)の報告を受理した後、速やかに厚生労働省へ報告する
こと。
(3)厚生労働省は、機構から(1)の報告を受理した後、速やかに都道府県に当該報
告を情報提供するので、当該報告を受け取った都道府県は、速やかに予防接種を実
施した市町村に情報提供すること。
(4)(1)の報告を行った場合には、厚生労働省において、医薬品医療機器等法第 68
条の 10 第2項の規定による報告としても取り扱うこととするため、医師等は、重ね
て同項の規定による報告をする必要はないこと。