よむ、つかう、まなぶ。
資料4-1 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第68条の12の規定に基づく薬事審議会への副作用等報告について[671KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和7年10月24日
令和7年度第2回
医薬品等安全対策部会
資料4-1
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第 68 条の 12
の規定に基づく薬事審議会への副作用等報告について・・・・
【報告期間】※ 1.(3)医薬品たるコンビネーション製品の報告状況を除く
今回報告分:令和7年4月1日から令和7年7月 31 日まで
前回報告分:令和6年 12 月1日から令和7年3月 31 日まで
(令和7年度第1回医薬品等安全対策部会)
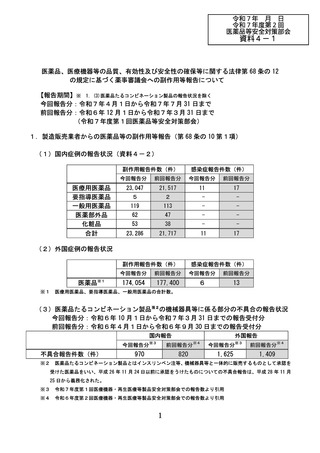
1.製造販売業者からの医薬品等の副作用等報告(第 68 条の 10 第1項)
(1)国内症例の報告状況(資料4-2)
医療用医薬品
要指導医薬品
一般用医薬品
医薬部外品
化粧品
合計
副作用報告件数(件)
感染症報告件数(件)
今回報告分
前回報告分
今回報告分
前回報告分
23,047
21,517
11
17
5
2
-
-
119
113
-
-
62
47
-
-
53
38
-
-
23,286
21,717
11
17
(2)外国症例の報告状況
医薬品※1
副作用報告件数(件)
感染症報告件数(件)
今回報告分
前回報告分
今回報告分
前回報告分
174,054
177,400
6
13
※1 医療用医薬品、要指導医薬品、一般用医薬品の合計数。
(3)医薬品たるコンビネーション製品※2の機械器具等に係る部分の不具合の報告状況
今回報告分:令和6年 10 月1日から令和7年3月 31 日までの報告受付分
前回報告分:令和6年4月1日から令和6年9月 30 日までの報告受付分
国内報告
今回報告分
不具合報告件数(件)
※3
外国報告
前回報告分
970
820
※4
今回報告分
1,625
※3
前回報告分
※4
1,409
※2 医薬品たるコンビネーション製品とはインスリンペン注等、機械器具等と一体的に販売するものとして承認を
受けた医薬品をいい、平成 26 年 11 月 24 日以前に承認をうけたものについての不具合報告は、平成 28 年 11 月
25 日から義務化された。
※3
令和7年度第1回医療機器・再生医療等製品安全対策部会での報告数より引用
※4
令和6年度第2回医療機器・再生医療等製品安全対策部会での報告数より引用
1
令和7年度第2回
医薬品等安全対策部会
資料4-1
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第 68 条の 12
の規定に基づく薬事審議会への副作用等報告について・・・・
【報告期間】※ 1.(3)医薬品たるコンビネーション製品の報告状況を除く
今回報告分:令和7年4月1日から令和7年7月 31 日まで
前回報告分:令和6年 12 月1日から令和7年3月 31 日まで
(令和7年度第1回医薬品等安全対策部会)
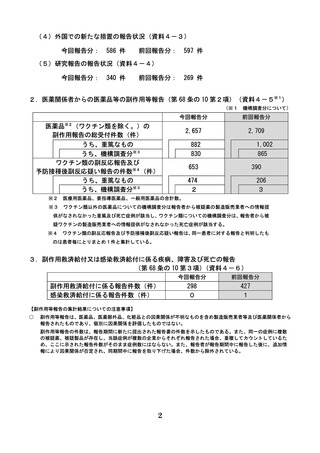
1.製造販売業者からの医薬品等の副作用等報告(第 68 条の 10 第1項)
(1)国内症例の報告状況(資料4-2)
医療用医薬品
要指導医薬品
一般用医薬品
医薬部外品
化粧品
合計
副作用報告件数(件)
感染症報告件数(件)
今回報告分
前回報告分
今回報告分
前回報告分
23,047
21,517
11
17
5
2
-
-
119
113
-
-
62
47
-
-
53
38
-
-
23,286
21,717
11
17
(2)外国症例の報告状況
医薬品※1
副作用報告件数(件)
感染症報告件数(件)
今回報告分
前回報告分
今回報告分
前回報告分
174,054
177,400
6
13
※1 医療用医薬品、要指導医薬品、一般用医薬品の合計数。
(3)医薬品たるコンビネーション製品※2の機械器具等に係る部分の不具合の報告状況
今回報告分:令和6年 10 月1日から令和7年3月 31 日までの報告受付分
前回報告分:令和6年4月1日から令和6年9月 30 日までの報告受付分
国内報告
今回報告分
不具合報告件数(件)
※3
外国報告
前回報告分
970
820
※4
今回報告分
1,625
※3
前回報告分
※4
1,409
※2 医薬品たるコンビネーション製品とはインスリンペン注等、機械器具等と一体的に販売するものとして承認を
受けた医薬品をいい、平成 26 年 11 月 24 日以前に承認をうけたものについての不具合報告は、平成 28 年 11 月
25 日から義務化された。
※3
令和7年度第1回医療機器・再生医療等製品安全対策部会での報告数より引用
※4
令和6年度第2回医療機器・再生医療等製品安全対策部会での報告数より引用
1