よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律」の施行に伴う「遺伝子治療等臨床研究に関する指針」の取扱いについて (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_57618.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第106回 5/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律」の施行に伴う
遺伝子治療等臨床研究に関する指針の取扱いについて
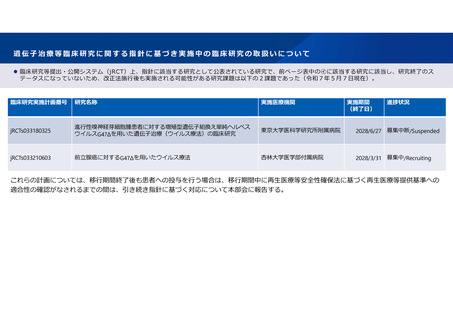
遺伝子治療等臨床研究については、「遺伝子治療等臨床研究に関する指針」(平成27年厚生労働省告示第344号。以下「指針」という。)に従い実施されて
きた。「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律」(令和 6年法律第 51 号。以下「改正法」という。)により再生
医療等の安全性の確保に関する法律(平成25年法律第85 号。以下「再生医療等安全性確保法」という。)の一部が改正され、令和7年5月31日に施行され、
in vivo 遺伝子治療等が新たに再生医療等安全性確保法に基づき実施されることとなる。
改正法の施行により再生医療等安全性確保法の対象となるin vivo遺伝子治療等は臨床研究の実施状況、時期に応じて以下の㋐、㋑の取扱いとする※1※2。
遺伝子治療等の技術
施行後の移行期間(1年間)以降
新たに患者への投与を行う場合
in vivo遺伝子治療等
新たに患者への投与を行わず、観察のみ
を行う場合
ex vivo遺伝子治療等
改正法施行前及び施行後移行期間の取扱い
指針(第1章及び第3章)+ 臨床研究法
or 指針(第1章から第3章)
改正法移行期間終了後の取扱い
区分
指針(第1章)+ 再生医療等安全性確保法
㋐
指針(第1章及び第3章)+ 臨床研究法 or 指針(第1章から第3章)
㋑
指針(第1章)+ 再生医療等安全性確保法
㋒
※1「医薬品、医療機器等の品質、安全性及び有効性の確保等に関する法律」(昭和35年法律第145号。以下「医薬品医療機器等法」という。)に規定する治験の場合には、in vivo、ex vivoに依
らず、改正法施行前後で取り扱いに変更はなく、指針(第1章)+医薬品医療機器等法が適用される。
※2 上記㋐~㋒以外にも、改正法施行後に、指針に基づく遺伝子治療等臨床研究が実施された被験者を対象に、新たに遺伝子治療等を行わずに、例えば、長期追跡のみを行う観察研究を新たに実
施する場合であって、当該研究が「人を対象とする生命科学・医学系研究に関する倫理指針」(令和3年文部科学省・厚生労働省・経済産業省告示第1号)が規定する人を対象とする生命科学・
医学系研究に該当する場合は、当該指針の規定に従う(従前と対応に変更はない)。
報告
事項
現に指針に基づき実施中のin vivo遺伝子治療等臨床研究であって、移行期間終了後に新たに患者への投与を実施しないもの(上記㋑)
については、従前のとおり、重篤な有害事象等が発生した場合には、指針に基づく対応を「遺伝子治療臨床研究に関する審査委員会」
で諮った上で、本部会に報告をする取扱いとする。
遺伝子治療等臨床研究に関する指針の取扱いについて
遺伝子治療等臨床研究については、「遺伝子治療等臨床研究に関する指針」(平成27年厚生労働省告示第344号。以下「指針」という。)に従い実施されて
きた。「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律」(令和 6年法律第 51 号。以下「改正法」という。)により再生
医療等の安全性の確保に関する法律(平成25年法律第85 号。以下「再生医療等安全性確保法」という。)の一部が改正され、令和7年5月31日に施行され、
in vivo 遺伝子治療等が新たに再生医療等安全性確保法に基づき実施されることとなる。
改正法の施行により再生医療等安全性確保法の対象となるin vivo遺伝子治療等は臨床研究の実施状況、時期に応じて以下の㋐、㋑の取扱いとする※1※2。
遺伝子治療等の技術
施行後の移行期間(1年間)以降
新たに患者への投与を行う場合
in vivo遺伝子治療等
新たに患者への投与を行わず、観察のみ
を行う場合
ex vivo遺伝子治療等
改正法施行前及び施行後移行期間の取扱い
指針(第1章及び第3章)+ 臨床研究法
or 指針(第1章から第3章)
改正法移行期間終了後の取扱い
区分
指針(第1章)+ 再生医療等安全性確保法
㋐
指針(第1章及び第3章)+ 臨床研究法 or 指針(第1章から第3章)
㋑
指針(第1章)+ 再生医療等安全性確保法
㋒
※1「医薬品、医療機器等の品質、安全性及び有効性の確保等に関する法律」(昭和35年法律第145号。以下「医薬品医療機器等法」という。)に規定する治験の場合には、in vivo、ex vivoに依
らず、改正法施行前後で取り扱いに変更はなく、指針(第1章)+医薬品医療機器等法が適用される。
※2 上記㋐~㋒以外にも、改正法施行後に、指針に基づく遺伝子治療等臨床研究が実施された被験者を対象に、新たに遺伝子治療等を行わずに、例えば、長期追跡のみを行う観察研究を新たに実
施する場合であって、当該研究が「人を対象とする生命科学・医学系研究に関する倫理指針」(令和3年文部科学省・厚生労働省・経済産業省告示第1号)が規定する人を対象とする生命科学・
医学系研究に該当する場合は、当該指針の規定に従う(従前と対応に変更はない)。
報告
事項
現に指針に基づき実施中のin vivo遺伝子治療等臨床研究であって、移行期間終了後に新たに患者への投与を実施しないもの(上記㋑)
については、従前のとおり、重篤な有害事象等が発生した場合には、指針に基づく対応を「遺伝子治療臨床研究に関する審査委員会」
で諮った上で、本部会に報告をする取扱いとする。