よむ、つかう、まなぶ。
参考資料2-3 血漿分画製剤のウイルスに対する安全性確保に関するガイドライン Q&A案 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24719.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和3年度第6回 3/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別添)
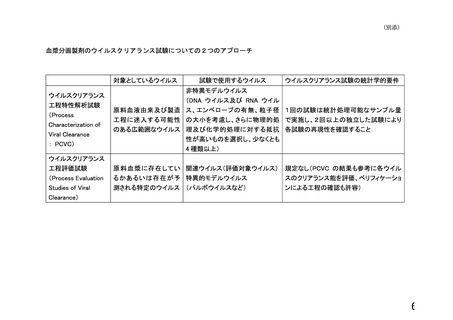
血漿分画製剤のウイルスクリアランス試験についての2つのアプローチ
対象としているウイルス
ウイルスクリアランス
工程特性解析試験
(Process
Characterization of
Viral Clearance
: PCVC)
試験で使用するウイルス
ウイルスクリアランス試験の統計学的要件
非特異モデルウイルス
(DNA ウイルス及び RNA ウイル
原料血液由来及び製造 ス、エンベロープの有無、粒子径 1回の試験は統計処理可能なサンプル量
工程に迷入する可能性 の大小を考慮し、さらに物理的処 で実施し、2回以上の独立した試験により
のある広範囲なウイルス 理及び化学的処理に対する抵抗 各試験の再現性を確認すること
性が高いものを選択し、少なくとも
4 種類以上)
ウイルスクリアランス
工程評価試験
(Process Evaluation
Studies of Viral
Clearance)
原料血漿に存在してい 関連ウイルス(評価対象ウイルス)
るかあるいは存在が予 特異的モデルウイルス
測される特定のウイルス (パルボウイルスなど)
規定なし(PCVC の結果も参考に各ウイル
スのクリアランス能を評価、ベリフィケーショ
ンによる工程の確認も許容)
6
血漿分画製剤のウイルスクリアランス試験についての2つのアプローチ
対象としているウイルス
ウイルスクリアランス
工程特性解析試験
(Process
Characterization of
Viral Clearance
: PCVC)
試験で使用するウイルス
ウイルスクリアランス試験の統計学的要件
非特異モデルウイルス
(DNA ウイルス及び RNA ウイル
原料血液由来及び製造 ス、エンベロープの有無、粒子径 1回の試験は統計処理可能なサンプル量
工程に迷入する可能性 の大小を考慮し、さらに物理的処 で実施し、2回以上の独立した試験により
のある広範囲なウイルス 理及び化学的処理に対する抵抗 各試験の再現性を確認すること
性が高いものを選択し、少なくとも
4 種類以上)
ウイルスクリアランス
工程評価試験
(Process Evaluation
Studies of Viral
Clearance)
原料血漿に存在してい 関連ウイルス(評価対象ウイルス)
るかあるいは存在が予 特異的モデルウイルス
測される特定のウイルス (パルボウイルスなど)
規定なし(PCVC の結果も参考に各ウイル
スのクリアランス能を評価、ベリフィケーショ
ンによる工程の確認も許容)
6