よむ、つかう、まなぶ。
参考資料2-3 血漿分画製剤のウイルスに対する安全性確保に関するガイドライン Q&A案 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24719.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和3年度第6回 3/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
果に関して統計学的に適切で妥当な処理が行えるよう、十分な測定サンプル数
で実施することが必要です。感染性を指標としないウイルス除去を定量的に行
う試験についても、その妥当性を明らかにした上で実施することで差し支えあ
りません。
また、低濃度のウイルス試料(例えば、ウイルス粒子数が1L当たり1~1000)
を取り扱う場合、ウイルス試料のサンプリングの仕方によって統計学上の大き
な誤差が生じる可能性を考慮して試験を設計する必要があります。
Q14.(6
ウイルスクリアランス試験に用いる測定法
6.3
統計)
ウイルスクリアランス工程評価試験においては、明確な統計学的要件はない
のでしょうか。
A14.
A13.で説明したように、ウイルスクリアランス工程特性解析試験におけるウ
イルス感染価及びウイルスクリアランス指数の算出には統計的な処理が可能な
ようにデザインする必要がありますが、原料に混入している可能性のある関連
ウイルスの評価として実施するウイルスクリアランス工程評価試験では必ずし
も統計的処理を求めるものではありません。対象とする関連ウイルスのウイル
スクリアランス能の評価にウイルスクリアランス工程特性解析試験の結果が使
える場合には、その結果を用いて関連ウイルスに対する安全性を評価すること
が可能です。
関連ウイルスが非常に特殊な特性を持っているために、ウイルスクリアラン
ス工程特性解析試験ではそのウイルスクリアランス能を説明できない場合には、
関連ウイルスないしはその特異的モデルウイルスを用いてウイルスクリアラン
ス能を評価する必要がある場合があります。ただし、その場合に上記のとおり、
ウイルスクリアランス工程特性解析試験のような統計学的処理までを求めるも
のではありません。
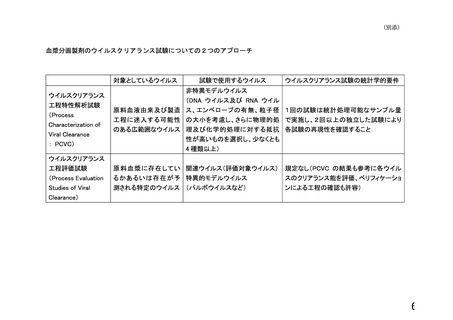
なお、別添の「血漿分画製剤のウイルスクリアランス試験についての2つのア
プローチ」も参考にしてください。
Q15.(用語)
ウイルスクリアランス工程特性解析試験のデータを用いてウイルスクリア
ランス工程評価試験を評価することが可能でしょうか。
A15.
選択したウイルスが、例えばウイルス粒子の大きさ(ナノフィルトレーション)
やパスツリゼーション(熱耐性)などの評価に用いることの妥当性が示されるの
であれば可能と考えられます。
5
5
で実施することが必要です。感染性を指標としないウイルス除去を定量的に行
う試験についても、その妥当性を明らかにした上で実施することで差し支えあ
りません。
また、低濃度のウイルス試料(例えば、ウイルス粒子数が1L当たり1~1000)
を取り扱う場合、ウイルス試料のサンプリングの仕方によって統計学上の大き
な誤差が生じる可能性を考慮して試験を設計する必要があります。
Q14.(6
ウイルスクリアランス試験に用いる測定法
6.3
統計)
ウイルスクリアランス工程評価試験においては、明確な統計学的要件はない
のでしょうか。
A14.
A13.で説明したように、ウイルスクリアランス工程特性解析試験におけるウ
イルス感染価及びウイルスクリアランス指数の算出には統計的な処理が可能な
ようにデザインする必要がありますが、原料に混入している可能性のある関連
ウイルスの評価として実施するウイルスクリアランス工程評価試験では必ずし
も統計的処理を求めるものではありません。対象とする関連ウイルスのウイル
スクリアランス能の評価にウイルスクリアランス工程特性解析試験の結果が使
える場合には、その結果を用いて関連ウイルスに対する安全性を評価すること
が可能です。
関連ウイルスが非常に特殊な特性を持っているために、ウイルスクリアラン
ス工程特性解析試験ではそのウイルスクリアランス能を説明できない場合には、
関連ウイルスないしはその特異的モデルウイルスを用いてウイルスクリアラン
ス能を評価する必要がある場合があります。ただし、その場合に上記のとおり、
ウイルスクリアランス工程特性解析試験のような統計学的処理までを求めるも
のではありません。
なお、別添の「血漿分画製剤のウイルスクリアランス試験についての2つのア
プローチ」も参考にしてください。
Q15.(用語)
ウイルスクリアランス工程特性解析試験のデータを用いてウイルスクリア
ランス工程評価試験を評価することが可能でしょうか。
A15.
選択したウイルスが、例えばウイルス粒子の大きさ(ナノフィルトレーション)
やパスツリゼーション(熱耐性)などの評価に用いることの妥当性が示されるの
であれば可能と考えられます。
5
5