よむ、つかう、まなぶ。
参考資料1-3:第23回臨床研究部会 参考資料1-6 令和3年度厚生労働科学特別研究事業「臨床研究法の見直し審議における新たな課題・論点への対応策の確立のための研究」班 医薬品に係る臨床試験を巡る各国の制度比較 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
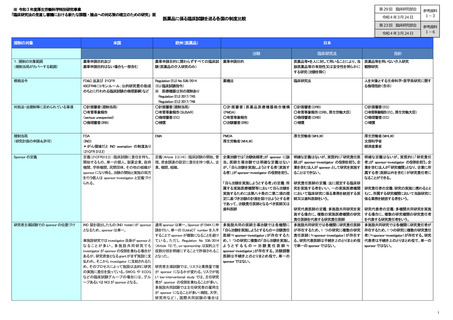
ECRIN や EORTC のような臨床試験グルー
プが sponsor を担う。患者団体が sponsor
になることもある。
Sponsor の責務
責務(21CFR312.50):研究者の選定、実施に
必要な情報の提供、モニタリング、計画やプロ
トコールの遵守、FDA と研究者への重大な有
害事象やリスクの通知など
治験責任医師の責務:治験実施計画書や手
順書、治験薬概要書等の作成、補償措置、治
験薬管理、副作用報告、モニタリング、監査、
治験審査委員会対応、委託業務の監督、総
括報告書作成など
研究責任医師の責務:研究計画書の作成、研
究の実施、研究の適切な実施の確保、疾病
等報告、不適合の管理、モニタリング、監査、
利益相反管理、CRB 対応、情報公開、試験薬
管理、被験者への同意、実施計画の提出、補
償措置、委託業務の監督、総括報告書作成
など
研究責任医師の責務:研究計画書の作成、記
録の保管、重篤な有害事象への対応、モニタ
リング、監査、利益相反管理、倫理審査委員
会への付議、情報公開、被験者への同意、補
償措置、委託業務の監督など
FDA へ報告
未知の死亡/死亡のおそれ:7 日
その他の未知重篤:15 日
責務:Sponsorの役割は医学的、資金的、法
的な責任を持つこと。保険をカバーするの
が重要な責務。SponsorがECと国からの許
可を得る責任がある。その他、プロトコール
や GCP 遵守を含めた investigator の監督、
有害事象報告、モニタリング、データ管理、
データ共有、試験薬・試料管理、データ保護
規則遵守など
EMA へ報告
未知の死亡/死亡のおそれ:7 日
その他の未知重篤:15 日
有害事象(安全性)の当局報告
厚生労働大臣へ報告
未知の死亡/死亡のおそれ:7 日
その他の未知重篤:15 日
既知の死亡/死亡のおそれ:15 日
厚生労働大臣へ報告
未知重篤:速やかに
臨床試験データの品質管理
(モニタリング)
)・品質保証(監査)
求められている
求められている
求められている
厚生労働大臣へ報告
<未承認・適応外>
未知の死亡/死亡のおそれ:7 日
その他の未知重篤:15 日
既知の死亡/死亡のおそれ:15 日
<既承認>
未知の死亡/死亡のおそれ:15 日
その他の未知重篤:15 日
既知の死亡:15 日
既知の死亡のおそれ/その他重篤:30 日
求められている
(監査は必要に応じて)
臨床試験データの保存期間
薬事承認後 2 年
不承認の場合には、試験薬の輸送が終わっ
て2年
(21CFR 312.57)
研究終了から 25 年間
薬事承認を受けた日又は治験の終了・中止後 研究終了日から 5 年間
3 年を経過した日のうち遅い日まで
利益相反管理
21CFR54, 42CFR50, 45CFR94 など厳しく求め
られている
罰則
○FDA によるブラックリスト管理
○医療機関に対する FWA 差し止め
(→各省庁が補助金支給を停止)
研究者の COI については記載なし(ヘルシ 治験についての規定はないが、治験審査委 機関内の事実確認、利益相反の内容や程度
ンキ宣言に従うという記載はあり)
員会において利益相反管理を実施
に応じた管理計画が求められている
規制当局の評価者が COI を避ける旨の記
プロトコール及び同意説明文書での記載を求
載あり。
められている
あり(加盟国で罰則を規定)
あり(薬機法)
あり(臨床研究法)
求められている(侵襲かつ介入ありの研究の
み、監査は必要に応じて)
研究終了報告日から5年を経過した日又は研
究結果の最終公表の報告日から 3 年を経過
した日のいずれか遅い日まで
各研究機関の基準にしたがってプロトコール
及び同意説明文書での記載を求められてい
る
なし
2
プが sponsor を担う。患者団体が sponsor
になることもある。
Sponsor の責務
責務(21CFR312.50):研究者の選定、実施に
必要な情報の提供、モニタリング、計画やプロ
トコールの遵守、FDA と研究者への重大な有
害事象やリスクの通知など
治験責任医師の責務:治験実施計画書や手
順書、治験薬概要書等の作成、補償措置、治
験薬管理、副作用報告、モニタリング、監査、
治験審査委員会対応、委託業務の監督、総
括報告書作成など
研究責任医師の責務:研究計画書の作成、研
究の実施、研究の適切な実施の確保、疾病
等報告、不適合の管理、モニタリング、監査、
利益相反管理、CRB 対応、情報公開、試験薬
管理、被験者への同意、実施計画の提出、補
償措置、委託業務の監督、総括報告書作成
など
研究責任医師の責務:研究計画書の作成、記
録の保管、重篤な有害事象への対応、モニタ
リング、監査、利益相反管理、倫理審査委員
会への付議、情報公開、被験者への同意、補
償措置、委託業務の監督など
FDA へ報告
未知の死亡/死亡のおそれ:7 日
その他の未知重篤:15 日
責務:Sponsorの役割は医学的、資金的、法
的な責任を持つこと。保険をカバーするの
が重要な責務。SponsorがECと国からの許
可を得る責任がある。その他、プロトコール
や GCP 遵守を含めた investigator の監督、
有害事象報告、モニタリング、データ管理、
データ共有、試験薬・試料管理、データ保護
規則遵守など
EMA へ報告
未知の死亡/死亡のおそれ:7 日
その他の未知重篤:15 日
有害事象(安全性)の当局報告
厚生労働大臣へ報告
未知の死亡/死亡のおそれ:7 日
その他の未知重篤:15 日
既知の死亡/死亡のおそれ:15 日
厚生労働大臣へ報告
未知重篤:速やかに
臨床試験データの品質管理
(モニタリング)
)・品質保証(監査)
求められている
求められている
求められている
厚生労働大臣へ報告
<未承認・適応外>
未知の死亡/死亡のおそれ:7 日
その他の未知重篤:15 日
既知の死亡/死亡のおそれ:15 日
<既承認>
未知の死亡/死亡のおそれ:15 日
その他の未知重篤:15 日
既知の死亡:15 日
既知の死亡のおそれ/その他重篤:30 日
求められている
(監査は必要に応じて)
臨床試験データの保存期間
薬事承認後 2 年
不承認の場合には、試験薬の輸送が終わっ
て2年
(21CFR 312.57)
研究終了から 25 年間
薬事承認を受けた日又は治験の終了・中止後 研究終了日から 5 年間
3 年を経過した日のうち遅い日まで
利益相反管理
21CFR54, 42CFR50, 45CFR94 など厳しく求め
られている
罰則
○FDA によるブラックリスト管理
○医療機関に対する FWA 差し止め
(→各省庁が補助金支給を停止)
研究者の COI については記載なし(ヘルシ 治験についての規定はないが、治験審査委 機関内の事実確認、利益相反の内容や程度
ンキ宣言に従うという記載はあり)
員会において利益相反管理を実施
に応じた管理計画が求められている
規制当局の評価者が COI を避ける旨の記
プロトコール及び同意説明文書での記載を求
載あり。
められている
あり(加盟国で罰則を規定)
あり(薬機法)
あり(臨床研究法)
求められている(侵襲かつ介入ありの研究の
み、監査は必要に応じて)
研究終了報告日から5年を経過した日又は研
究結果の最終公表の報告日から 3 年を経過
した日のいずれか遅い日まで
各研究機関の基準にしたがってプロトコール
及び同意説明文書での記載を求められてい
る
なし
2