よむ、つかう、まなぶ。
参考資料1-3:第23回臨床研究部会 参考資料1-6 令和3年度厚生労働科学特別研究事業「臨床研究法の見直し審議における新たな課題・論点への対応策の確立のための研究」班 医薬品に係る臨床試験を巡る各国の制度比較 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※ 令和 3 年度厚生労働科学特別研究事業
「臨床研究法の見直し審議における新たな課題・論点への対応策の確立のための研究」班
第 29 回 臨床研究部会
令和 4 年3月 24 日
医薬品に係る臨床試験を巡る各国の制度比較
第 23 回 臨床研究部会
令和 4 年3月 24 日
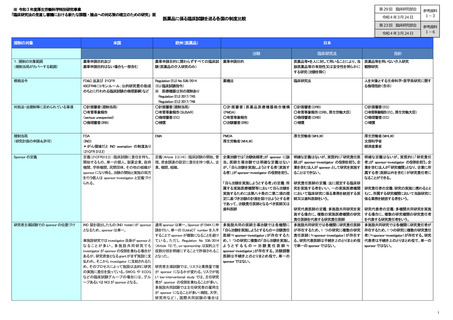
規制の対象
米国
欧州(医薬品)
参考資料
1-3
参考資料
1-6
日本
治験
指針
1.規制の対象範囲
(規制当局がカバーする範囲)
薬事申請目的及び
薬事申請目的はない場合も一部含む
根拠法令
FD&C 法及び 21CFR
Regulation (EU) No 536/2014
45CFR46(コモンルール;公的研究費の助成 (EU 臨床試験指令)
のもとに行われる臨床試験の倫理要綱)など
※ 医療機器は別の規制あり
Regulation (EU) 2017/745
Regulation (EU) 2017/746
○計画審査(規制当局)
○計画審査(規制当局)
○有害事象報告
○有害事象報告(SUSAR)
(serious unexpected)
○倫理審査(EC)
○倫理審査(IRB)
○補償
薬機法
臨床研究法
人を対象とする生命科学・医学系研究に関す
る倫理指針(告示)
○ 計画審査( 医薬品医療機器総合機構
(PMDA)
○有害事象報告
○治験審査(IRB)
○計画審査(CRB)
○有害事象報告(CRB、厚生労働大臣)
○倫理審査(CRB)
〇補償
○計画審査(EC)
○有害事象報告(EC、厚生労働大臣)
○倫理審査(EC)
〇補償
FDA
(IND)
*がん領域だと IND exemption の制度あり
(21CFR 312.2)
定義(21CFR312.3):臨床試験に責任を持ち、
開始するもの。単一の個人、製薬企業、政府
機関、学術機関、民間団体、その他の組織が
sponsor になり得る。治験の開始と実施の両方
を行う個人は sponsor-investigator と定義づけ
られる。
PMDA
厚生労働省(MHLW)
厚生労働省(MHLW)
厚生労働省(MHLW)
文部科学省
経済産業省
明確な定義はないが、実質的に「研究責任医
師」が sponsor-investigator の役割を担う。企
業を含む法人が sponsor として研究を実施す
ることはできない。
明確な定義はないが、実質的に「研究責任
者」が sponsor-investigator の役割を担う。企
業を含む法人が「研究機関」となり、企業に所
属する者(医師以外を含む)が研究責任者に
なることができる。
対処法・法規制等に定められている事項
規制当局
(研究計画の申請&許可)
Sponsor の定義
研究者主導試験での sponsor の位置づけ
薬事申請目的に関わらずすべての臨床試 薬事申請目的
験(医薬品の介入研究のみ)
臨床研究法
EMA
定義(Article 2.3.(14)):臨床試験の開始、管 企業治験では「治験依頼者」が sponsor に該
理、資金調達の設定に責任を持つ個人、企 当。医師主導治験では明確な定義はない
業、機関、組織。
が、「自ら治験を実施しようとする者(実施す
る者)」が sponsor-investigator の役割を担う。
「自ら治験を実施しようとする者」の定義:所
属する実施医療機関等において自ら治験を
実施するために法第八十条の二第二項の規
定に基づき治験の計画を届け出ようとする者
であって、治験責任医師となるべき医師又は
歯科医師
医薬品等*を人に対して用いることにより、当 医薬品等を用いない介入研究
該医薬品等の有効性又は安全性を明らかに 観察研究
する研究(治験を除く)
研究責任医師の定義:法に規定する臨床研
究を実施する者をいい、一の実施医療機関 研究責任者の定義:研究の実施に携わるとと
において臨床研究に係る業務を統括する医 もに、所属する研究機関において当該研究に
師又は歯科医師をいう。
係る業務を統括する者をいう。
研究代表医師の定義:多施設共同研究を実
施する場合に、複数の実施医療機関の研究
責任医師を代表する研究責任医師
IND 届を提出したもの(IND holder)が sponsor 通常 sponsor は単一。Sponsor が EMA に申 多施設共同の医師主導治験では各機関に 多施設共同研究では各機関に研究責任医師
となるため、sponsor は単一。
請を行い、単一の EUdraCT number を入手 「自ら治験を実施しようとするもの=治験責任 が存在するため、1 つの研究に複数の研究
することで sponsor が複数になることを避け 医師≒sponsor-investigator」が存在するた 責任医師(≒sponsor-investigator)が存在す
単施設研究では investigator 自身が sponsor と ている 。ただし Regulation No 536/2014 め、1 つの研究に複数の「自ら治験を実施し る。研究代表医師は手続き上のとりまとめ役
な る こ と が 多 い 。 多 施 設 共 同 研 究 で も (Article 73)で、co-sponsorship は契約上で よ う と す る も の = 治 験 責 任 医 師 ≒ で単一の sponsor ではない。
investigator が sponsor の役割を兼ねる場合が 役割分担を明確にすることで許容されるこ sponsor-investigator」が存在する。治験調整
あるが、研究資金となるgrantがまず施設に支 となった。
医師は手続き上のとりまとめ役で、単一の
払われ、そこから investigator に支給されるた
sponsor ではない。
め、そのプロセスによって施設は法的に研究 研究者主導試験では、リスクと業務量で誰
の実施に責任を負っている。SWOG や ECOG が sponsor になるかが変わる。リスクが低
などの臨床試験グループの場合には、グル い low-interventional study では、主任研究
ープあるいは NCI が sponsor となる。
者が sponsor の役割を兼ねることが多い。
多施設共同試験では主任研究者の雇用主
が sponsor になることが多い(病院、大学、
研究所など) 。国際共同試験の場合は
研究代表者の定義:多機関共同研究を実施
する場合に、複数の研究機関の研究責任者
を代表する研究責任者をいう。
多施設共同研究では各機関に研究責任者が
存在するため、1 つの研究に複数の研究責任
者(≒sponsor-investigator)が存在する。研究
代表者は手続き上のとりまとめ役で、単一の
sponsor ではない。
1
「臨床研究法の見直し審議における新たな課題・論点への対応策の確立のための研究」班
第 29 回 臨床研究部会
令和 4 年3月 24 日
医薬品に係る臨床試験を巡る各国の制度比較
第 23 回 臨床研究部会
令和 4 年3月 24 日
規制の対象
米国
欧州(医薬品)
参考資料
1-3
参考資料
1-6
日本
治験
指針
1.規制の対象範囲
(規制当局がカバーする範囲)
薬事申請目的及び
薬事申請目的はない場合も一部含む
根拠法令
FD&C 法及び 21CFR
Regulation (EU) No 536/2014
45CFR46(コモンルール;公的研究費の助成 (EU 臨床試験指令)
のもとに行われる臨床試験の倫理要綱)など
※ 医療機器は別の規制あり
Regulation (EU) 2017/745
Regulation (EU) 2017/746
○計画審査(規制当局)
○計画審査(規制当局)
○有害事象報告
○有害事象報告(SUSAR)
(serious unexpected)
○倫理審査(EC)
○倫理審査(IRB)
○補償
薬機法
臨床研究法
人を対象とする生命科学・医学系研究に関す
る倫理指針(告示)
○ 計画審査( 医薬品医療機器総合機構
(PMDA)
○有害事象報告
○治験審査(IRB)
○計画審査(CRB)
○有害事象報告(CRB、厚生労働大臣)
○倫理審査(CRB)
〇補償
○計画審査(EC)
○有害事象報告(EC、厚生労働大臣)
○倫理審査(EC)
〇補償
FDA
(IND)
*がん領域だと IND exemption の制度あり
(21CFR 312.2)
定義(21CFR312.3):臨床試験に責任を持ち、
開始するもの。単一の個人、製薬企業、政府
機関、学術機関、民間団体、その他の組織が
sponsor になり得る。治験の開始と実施の両方
を行う個人は sponsor-investigator と定義づけ
られる。
PMDA
厚生労働省(MHLW)
厚生労働省(MHLW)
厚生労働省(MHLW)
文部科学省
経済産業省
明確な定義はないが、実質的に「研究責任医
師」が sponsor-investigator の役割を担う。企
業を含む法人が sponsor として研究を実施す
ることはできない。
明確な定義はないが、実質的に「研究責任
者」が sponsor-investigator の役割を担う。企
業を含む法人が「研究機関」となり、企業に所
属する者(医師以外を含む)が研究責任者に
なることができる。
対処法・法規制等に定められている事項
規制当局
(研究計画の申請&許可)
Sponsor の定義
研究者主導試験での sponsor の位置づけ
薬事申請目的に関わらずすべての臨床試 薬事申請目的
験(医薬品の介入研究のみ)
臨床研究法
EMA
定義(Article 2.3.(14)):臨床試験の開始、管 企業治験では「治験依頼者」が sponsor に該
理、資金調達の設定に責任を持つ個人、企 当。医師主導治験では明確な定義はない
業、機関、組織。
が、「自ら治験を実施しようとする者(実施す
る者)」が sponsor-investigator の役割を担う。
「自ら治験を実施しようとする者」の定義:所
属する実施医療機関等において自ら治験を
実施するために法第八十条の二第二項の規
定に基づき治験の計画を届け出ようとする者
であって、治験責任医師となるべき医師又は
歯科医師
医薬品等*を人に対して用いることにより、当 医薬品等を用いない介入研究
該医薬品等の有効性又は安全性を明らかに 観察研究
する研究(治験を除く)
研究責任医師の定義:法に規定する臨床研
究を実施する者をいい、一の実施医療機関 研究責任者の定義:研究の実施に携わるとと
において臨床研究に係る業務を統括する医 もに、所属する研究機関において当該研究に
師又は歯科医師をいう。
係る業務を統括する者をいう。
研究代表医師の定義:多施設共同研究を実
施する場合に、複数の実施医療機関の研究
責任医師を代表する研究責任医師
IND 届を提出したもの(IND holder)が sponsor 通常 sponsor は単一。Sponsor が EMA に申 多施設共同の医師主導治験では各機関に 多施設共同研究では各機関に研究責任医師
となるため、sponsor は単一。
請を行い、単一の EUdraCT number を入手 「自ら治験を実施しようとするもの=治験責任 が存在するため、1 つの研究に複数の研究
することで sponsor が複数になることを避け 医師≒sponsor-investigator」が存在するた 責任医師(≒sponsor-investigator)が存在す
単施設研究では investigator 自身が sponsor と ている 。ただし Regulation No 536/2014 め、1 つの研究に複数の「自ら治験を実施し る。研究代表医師は手続き上のとりまとめ役
な る こ と が 多 い 。 多 施 設 共 同 研 究 で も (Article 73)で、co-sponsorship は契約上で よ う と す る も の = 治 験 責 任 医 師 ≒ で単一の sponsor ではない。
investigator が sponsor の役割を兼ねる場合が 役割分担を明確にすることで許容されるこ sponsor-investigator」が存在する。治験調整
あるが、研究資金となるgrantがまず施設に支 となった。
医師は手続き上のとりまとめ役で、単一の
払われ、そこから investigator に支給されるた
sponsor ではない。
め、そのプロセスによって施設は法的に研究 研究者主導試験では、リスクと業務量で誰
の実施に責任を負っている。SWOG や ECOG が sponsor になるかが変わる。リスクが低
などの臨床試験グループの場合には、グル い low-interventional study では、主任研究
ープあるいは NCI が sponsor となる。
者が sponsor の役割を兼ねることが多い。
多施設共同試験では主任研究者の雇用主
が sponsor になることが多い(病院、大学、
研究所など) 。国際共同試験の場合は
研究代表者の定義:多機関共同研究を実施
する場合に、複数の研究機関の研究責任者
を代表する研究責任者をいう。
多施設共同研究では各機関に研究責任者が
存在するため、1 つの研究に複数の研究責任
者(≒sponsor-investigator)が存在する。研究
代表者は手続き上のとりまとめ役で、単一の
sponsor ではない。
1