よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて-5-1 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00142.html |
| 出典情報 | 中央社会保険医療協議会 総会(第518回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
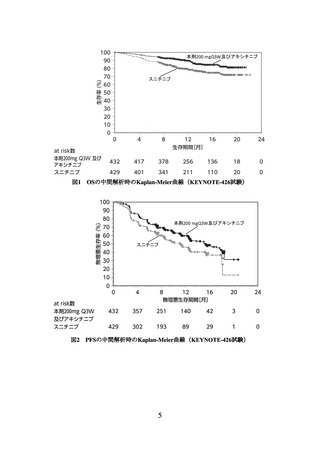
② 国際共同第Ⅲ相試験(E7080-307/KEYNOTE-581 試験)
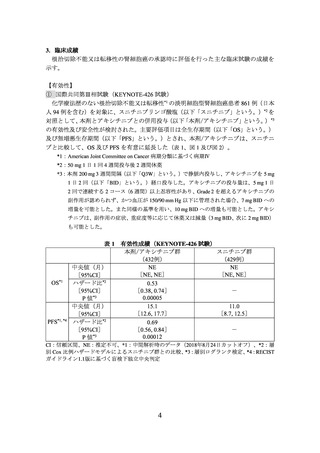
化学療法歴のない根治切除不能又は転移性の淡明細胞型腎細胞癌患者*1 712 例(日本
人 73 例を含む)を対象に、スニチニブ*2 を対照として、本剤とレンバチニブメシル酸
塩(以下「レンバチニブ」という。)の併用投与(以下「本剤/レンバチニブ」という。)
*3
の有効性及び安全性が検討された。本剤/レンバチニブは、
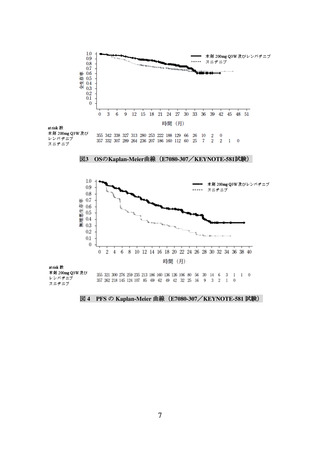
主要評価項目とされた PFS、
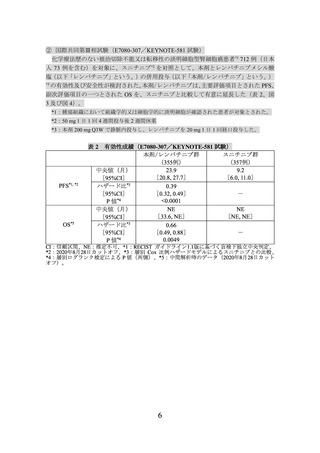
副次評価項目の一つとされた OS を、スニチニブと比較して有意に延長した(表 2、図
3 及び図 4)。
*1:腫瘍組織において組織学的又は細胞学的に淡明細胞が確認された患者が対象とされた。
*2:50 mg 1 日 1 回 4 週間投与後 2 週間休薬
*3:本剤 200 mg Q3W で静脈内投与し、レンバチニブを 20 mg 1 日 1 回経口投与した。
PFS*1, *2
OS*5
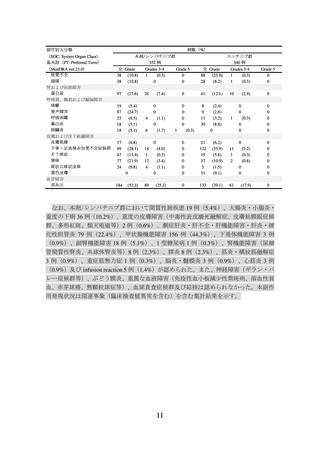
表 2 有効性成績(E7080-307/KEYNOTE-581 試験)
本剤/レンバチニブ群
スニチニブ群
(355例)
(357例)
23.9
9.2
中央値(月)
[20.8, 27.7]
[6.0, 11.0]
[95%CI]
ハザード比*3
0.39
[95%CI]
[0.32, 0.49]
-
*4
<0.0001
P値
NE
NE
中央値(月)
[33.6, NE]
[NE, NE]
[95%CI]
ハザード比*3
0.66
[95%CI]
[0.49, 0.88]
-
*4
0.0049
P値
CI:信頼区間、NE:推定不可、*1:RECIST ガイドライン1.1版に基づく盲検下独立中央判定、
*2:2020年8月28日カットオフ、*3:層別 Cox 比例ハザードモデルによるスニチニブとの比較、
*4:層別ログランク検定による P 値(両側)、*5:中間解析時のデータ(2020年8月28日カット
オフ)。
6
化学療法歴のない根治切除不能又は転移性の淡明細胞型腎細胞癌患者*1 712 例(日本
人 73 例を含む)を対象に、スニチニブ*2 を対照として、本剤とレンバチニブメシル酸
塩(以下「レンバチニブ」という。)の併用投与(以下「本剤/レンバチニブ」という。)
*3
の有効性及び安全性が検討された。本剤/レンバチニブは、
主要評価項目とされた PFS、
副次評価項目の一つとされた OS を、スニチニブと比較して有意に延長した(表 2、図
3 及び図 4)。
*1:腫瘍組織において組織学的又は細胞学的に淡明細胞が確認された患者が対象とされた。
*2:50 mg 1 日 1 回 4 週間投与後 2 週間休薬
*3:本剤 200 mg Q3W で静脈内投与し、レンバチニブを 20 mg 1 日 1 回経口投与した。
PFS*1, *2
OS*5
表 2 有効性成績(E7080-307/KEYNOTE-581 試験)
本剤/レンバチニブ群
スニチニブ群
(355例)
(357例)
23.9
9.2
中央値(月)
[20.8, 27.7]
[6.0, 11.0]
[95%CI]
ハザード比*3
0.39
[95%CI]
[0.32, 0.49]
-
*4
<0.0001
P値
NE
NE
中央値(月)
[33.6, NE]
[NE, NE]
[95%CI]
ハザード比*3
0.66
[95%CI]
[0.49, 0.88]
-
*4
0.0049
P値
CI:信頼区間、NE:推定不可、*1:RECIST ガイドライン1.1版に基づく盲検下独立中央判定、
*2:2020年8月28日カットオフ、*3:層別 Cox 比例ハザードモデルによるスニチニブとの比較、
*4:層別ログランク検定による P 値(両側)、*5:中間解析時のデータ(2020年8月28日カット
オフ)。
6