よむ、つかう、まなぶ。
【資料3】治験の更なる効率化(エコシステム)について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38892.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第9回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
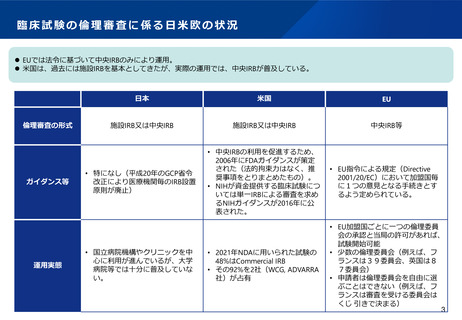
治験実施の煩雑さ
欧米と比較して、日本の治験実施は以下のような点で煩雑であると指摘されている。
⚫ 科学的・倫理的な影響がない軽微な変更についても審議が必要として運用している場合がある:プロトコール等の変更
のない、単なる実施医療機関の追加など、科学的・倫理的な影響がないものであっても、現状、IRB(治験審査委員会)
での審議が必要と考えられている。
⚫ 安全性情報に関する審議が膨大となる領域・製品がある:治験依頼者が知り得た治験薬に係る未知の有害事象等(治験
外で発生したものを含む)について、随時、実施医療機関に通知されることから、有害事象の発生件数の多い領域・製
品(抗がん剤等)では、審議に要する手間が膨大となる。欧米では、責任医師が審議の要否を判断できる。また、日本
では外国の同一有効成分の市販後の安全性情報も含まれるが、欧米では、治験依頼者が治験実施施設に通知する安全性
情報は基本的に治験を情報源とするものであり、市販後の個別副作用情報については対象とならない。有害事象報告の
審議を多くの委員に分担して行うことにより効率的に審議できる可能性があるが、IRBの成立要件が過半数の委員出席と
されていることから、効率化に限りがある。
⚫ 同意説明文書(ICF)の様式が医療機関ごと・依頼者ごとに異なる:基本的にはICFは依頼者が原案を作成するため、依頼
者によって様式が異なる。また、実際にICFを使用するのは医療機関であることから、医療機関様式での再作成、治験責
任医師、CRC、IRB委員の指摘で医療機関が使用する上で必要な修正を求める場合がある。ICF完成までに時間を要し、ま
た、ICFはIRBの審議対象であることから、修正のたびに審議が必要となる。
⚫ 全体的にオーバークオリティとなっている:逸脱を起こさないことへの意識が高く、モニタリングの頻度を含め、必要
以上に慎重かつ丁寧に業務が行われる結果、CRAが担当できる医療機関の数が欧米と比べて少ない。リスクに基づく体系
的なモニタリングの導入が部分的であり、出口管理中心のモニタリングとなる傾向がある。また、厳しくなりすぎない
ように運用しようとしても、どの程度の水準であれば規制上許容されるかについて、相談する機会がないことが原因の
一端でもある(実施医療機関が治験依頼者に相談すると、最も高水準な対応を求められる場合が多い)。治験申請前の
事務局ヒアリング、医局ヒアリング、その他院内各部門の個別訪問等のために発生するCRAの訪問頻度の改善と医療機関
とのやり取りの効率化の検討が必要である。
7
欧米と比較して、日本の治験実施は以下のような点で煩雑であると指摘されている。
⚫ 科学的・倫理的な影響がない軽微な変更についても審議が必要として運用している場合がある:プロトコール等の変更
のない、単なる実施医療機関の追加など、科学的・倫理的な影響がないものであっても、現状、IRB(治験審査委員会)
での審議が必要と考えられている。
⚫ 安全性情報に関する審議が膨大となる領域・製品がある:治験依頼者が知り得た治験薬に係る未知の有害事象等(治験
外で発生したものを含む)について、随時、実施医療機関に通知されることから、有害事象の発生件数の多い領域・製
品(抗がん剤等)では、審議に要する手間が膨大となる。欧米では、責任医師が審議の要否を判断できる。また、日本
では外国の同一有効成分の市販後の安全性情報も含まれるが、欧米では、治験依頼者が治験実施施設に通知する安全性
情報は基本的に治験を情報源とするものであり、市販後の個別副作用情報については対象とならない。有害事象報告の
審議を多くの委員に分担して行うことにより効率的に審議できる可能性があるが、IRBの成立要件が過半数の委員出席と
されていることから、効率化に限りがある。
⚫ 同意説明文書(ICF)の様式が医療機関ごと・依頼者ごとに異なる:基本的にはICFは依頼者が原案を作成するため、依頼
者によって様式が異なる。また、実際にICFを使用するのは医療機関であることから、医療機関様式での再作成、治験責
任医師、CRC、IRB委員の指摘で医療機関が使用する上で必要な修正を求める場合がある。ICF完成までに時間を要し、ま
た、ICFはIRBの審議対象であることから、修正のたびに審議が必要となる。
⚫ 全体的にオーバークオリティとなっている:逸脱を起こさないことへの意識が高く、モニタリングの頻度を含め、必要
以上に慎重かつ丁寧に業務が行われる結果、CRAが担当できる医療機関の数が欧米と比べて少ない。リスクに基づく体系
的なモニタリングの導入が部分的であり、出口管理中心のモニタリングとなる傾向がある。また、厳しくなりすぎない
ように運用しようとしても、どの程度の水準であれば規制上許容されるかについて、相談する機会がないことが原因の
一端でもある(実施医療機関が治験依頼者に相談すると、最も高水準な対応を求められる場合が多い)。治験申請前の
事務局ヒアリング、医局ヒアリング、その他院内各部門の個別訪問等のために発生するCRAの訪問頻度の改善と医療機関
とのやり取りの効率化の検討が必要である。
7