よむ、つかう、まなぶ。
【資料3】治験の更なる効率化(エコシステム)について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38892.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第9回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
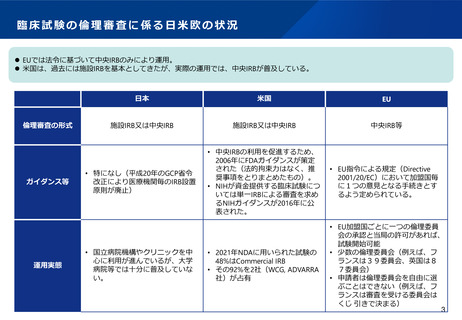
臨床試験の倫理審査に係る日米欧の状況
⚫ EUでは法令に基づいて中央IRBのみにより運用。
⚫ 米国は、過去には施設IRBを基本としてきたが、実際の運用では、中央IRBが普及している。
倫理審査の形式
ガイダンス等
運用実態
日本
米国
EU
施設IRB又は中央IRB
施設IRB又は中央IRB
中央IRB等
• 特になし(平成20年のGCP省令
改正により医療機関毎のIRB設置
原則が廃止)
• 中央IRBの利用を促進するため、
2006年にFDAガイダンスが策定
された(法的拘束力はなく、推
奨事項をとりまとめたもの)。
• NIHが資金提供する臨床試験につ
いては単一IRBによる審査を求め
るNIHガイダンスが2016年に公
表された。
• EU指令による規定(Directive
2001/20/EC)において加盟国毎
に1つの意見となる手続きとす
るよう定められている。
• 2021年NDAに用いられた試験の
48%はCommercial IRB
• その92%を2社(WCG, ADVARRA
社)が占有
• EU加盟国ごとに一つの倫理委員
会の承認と当局の許可があれば、
試験開始可能
• 少数の倫理委員会(例えば、フ
ランスは39委員会、英国は8
7委員会)
• 申請者は倫理委員会を自由に選
ぶことはできない(例えば、フ
ランスは審査を受ける委員会は
くじ 引きで決まる)
3
• 国立病院機構やクリニックを中
心に利用が進んでいるが、大学
病院等では十分に普及していな
い。
⚫ EUでは法令に基づいて中央IRBのみにより運用。
⚫ 米国は、過去には施設IRBを基本としてきたが、実際の運用では、中央IRBが普及している。
倫理審査の形式
ガイダンス等
運用実態
日本
米国
EU
施設IRB又は中央IRB
施設IRB又は中央IRB
中央IRB等
• 特になし(平成20年のGCP省令
改正により医療機関毎のIRB設置
原則が廃止)
• 中央IRBの利用を促進するため、
2006年にFDAガイダンスが策定
された(法的拘束力はなく、推
奨事項をとりまとめたもの)。
• NIHが資金提供する臨床試験につ
いては単一IRBによる審査を求め
るNIHガイダンスが2016年に公
表された。
• EU指令による規定(Directive
2001/20/EC)において加盟国毎
に1つの意見となる手続きとす
るよう定められている。
• 2021年NDAに用いられた試験の
48%はCommercial IRB
• その92%を2社(WCG, ADVARRA
社)が占有
• EU加盟国ごとに一つの倫理委員
会の承認と当局の許可があれば、
試験開始可能
• 少数の倫理委員会(例えば、フ
ランスは39委員会、英国は8
7委員会)
• 申請者は倫理委員会を自由に選
ぶことはできない(例えば、フ
ランスは審査を受ける委員会は
くじ 引きで決まる)
3
• 国立病院機構やクリニックを中
心に利用が進んでいるが、大学
病院等では十分に普及していな
い。