よむ、つかう、まなぶ。
総ー2 参考1○最適使用推進ガイドラインについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00249.html |
| 出典情報 | 中央社会保険医療協議会 総会(第585回 3/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.臨床成績
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍の承認時に評価を行った主な臨床試
験の成績を示す。
【有効性】
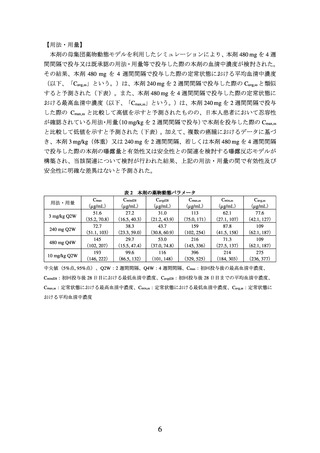
① 国内第Ⅱ相試験(KCTR-D014 試験)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍患者 31 例(有棘細胞癌 20 例、基底
細胞癌 2 例、乳房外パジェット病 4 例、皮膚付属器癌 5 例(エクリン汗孔癌 3 例、汗腺
癌 1 例、皮膚粘液癌 1 例))を対象に、本剤 480 mg を 4 週間間隔で点滴静注した。主要
評価項目である奏効率(RECIST ガイドライン 1.1 版に基づく独立中央判定による CR 又
は PR)は 19.4%(95%信頼区間:7.5~37.5%)であった。なお、事前に設定した閾値は
5.0%であった。
病理組織型別の奏効率(RECIST ガイドライン 1.1 版に基づく独立中央判定による CR
又は PR)は、有棘細胞癌 20.0%(95%信頼区間:5.7~43.7%)、基底細胞癌 50.0%(95%
信頼区間:1.3~98.7%)、乳房外パジェット病 25.0%(95%信頼区間:0.6~80.6%)、皮
膚付属器癌 0%であった。
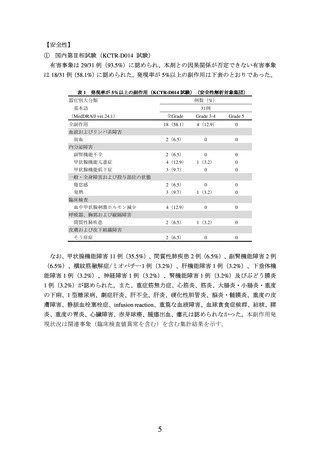
また、標的病変の腫瘍径和のベースラインからの最良変化率(RECIST ガイドライン 1.1
版に基づく独立中央判定)は下図のとおりであった。
図 1 標的病変の腫瘍径和のベースラインからの最良変化率
(RECIST ガイドライン 1.1 版、独立中央判定、2021 年 9 月 17 日データカットオフ)
4
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍の承認時に評価を行った主な臨床試
験の成績を示す。
【有効性】
① 国内第Ⅱ相試験(KCTR-D014 試験)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍患者 31 例(有棘細胞癌 20 例、基底
細胞癌 2 例、乳房外パジェット病 4 例、皮膚付属器癌 5 例(エクリン汗孔癌 3 例、汗腺
癌 1 例、皮膚粘液癌 1 例))を対象に、本剤 480 mg を 4 週間間隔で点滴静注した。主要
評価項目である奏効率(RECIST ガイドライン 1.1 版に基づく独立中央判定による CR 又
は PR)は 19.4%(95%信頼区間:7.5~37.5%)であった。なお、事前に設定した閾値は
5.0%であった。
病理組織型別の奏効率(RECIST ガイドライン 1.1 版に基づく独立中央判定による CR
又は PR)は、有棘細胞癌 20.0%(95%信頼区間:5.7~43.7%)、基底細胞癌 50.0%(95%
信頼区間:1.3~98.7%)、乳房外パジェット病 25.0%(95%信頼区間:0.6~80.6%)、皮
膚付属器癌 0%であった。
また、標的病変の腫瘍径和のベースラインからの最良変化率(RECIST ガイドライン 1.1
版に基づく独立中央判定)は下図のとおりであった。
図 1 標的病変の腫瘍径和のベースラインからの最良変化率
(RECIST ガイドライン 1.1 版、独立中央判定、2021 年 9 月 17 日データカットオフ)
4