よむ、つかう、まなぶ。
資料2:臨床研究法の見直しについて (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37286.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第34回 1/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(参考)対応済み項目について
「臨床研究法施行5年後の見直しに係る検討のとりまとめ」における、既に対応済みの事項のまとめ
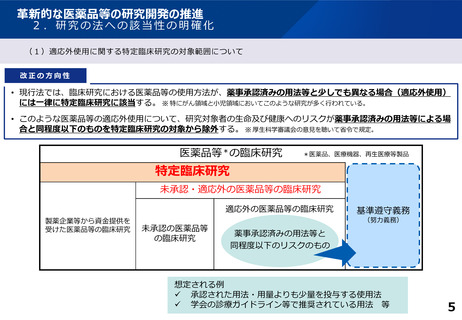
革新的な医薬品等の研究開発の推進
1.臨床研究実施体制の国際整合性
(1)研究全体の責任主体の概念について
※ 再審査・再評価に係る製造販売後臨床試験以外の製造販売後の臨床試験については、薬機法下の適切な基準に準拠して実施できるよう、薬機法及び
臨床研究法の施行規則を改正した。(令和4年9月30日 省令改正)
(2)特定臨床研究で得られた情報の薬事申請における利活用について
※ 特定臨床研究で得られた試験成績を利用し、実際に薬事申請に至った個別の申請事例をもとに、適切な信頼性確保を講じる上での留意点・考え方を一
例として示した。(令和5年3月31日 医薬・生活衛生局医薬品審査管理課 事務連絡)
3.手続の合理化
(1)届出・変更手続きの合理化、届出のオンライン化について
※ 特定臨床研究の実施計画の変更手続に関して、軽微な変更に該当する事項を追加するとともに、jRCTへの掲載のみとする項目を実施計画の記載事項
から削除するため、施行規則における所要の改正を行った。(令和4年3月31日 省令改正)
※ jRCTの改修を行うなど必要な対応を進め、特定臨床研究の実施計画等の国への届出をオンライン化した。
研究の信頼性確保
1.透明性の確保
(3)重大な不適合の取扱いについて
※ 実施医療機関の管理者は、特定臨床研究において重大な不適合の発生を知ったときは、その旨を公表すべきことについて通知を行った。
(令和4年3月31日 医政局研究開発振興課長通知)
2.研究の質の確保
(1)臨床研究審査委員会の認定要件について
※ CRBの更新要件について省令改正を行い、一定の経過措置を設けた上で、新規の審議件数は3年間で6件以上(ただし、毎年1件以上)、かつ、開
催回数については毎年7回以上に見直しを行った。(令和4年3月31日 省令改正)
※ 更新要件を満たさないCRBについては、円滑な廃止に向けて準備を進めていただくものとし、これまでに発出したCRBの更新に係る事務連絡を廃止した上
で、改めてCRBの更新に関する考え方を示した。(令和4年3月31日医政局研究開発振興課 事務連絡)
6
「臨床研究法施行5年後の見直しに係る検討のとりまとめ」における、既に対応済みの事項のまとめ
革新的な医薬品等の研究開発の推進
1.臨床研究実施体制の国際整合性
(1)研究全体の責任主体の概念について
※ 再審査・再評価に係る製造販売後臨床試験以外の製造販売後の臨床試験については、薬機法下の適切な基準に準拠して実施できるよう、薬機法及び
臨床研究法の施行規則を改正した。(令和4年9月30日 省令改正)
(2)特定臨床研究で得られた情報の薬事申請における利活用について
※ 特定臨床研究で得られた試験成績を利用し、実際に薬事申請に至った個別の申請事例をもとに、適切な信頼性確保を講じる上での留意点・考え方を一
例として示した。(令和5年3月31日 医薬・生活衛生局医薬品審査管理課 事務連絡)
3.手続の合理化
(1)届出・変更手続きの合理化、届出のオンライン化について
※ 特定臨床研究の実施計画の変更手続に関して、軽微な変更に該当する事項を追加するとともに、jRCTへの掲載のみとする項目を実施計画の記載事項
から削除するため、施行規則における所要の改正を行った。(令和4年3月31日 省令改正)
※ jRCTの改修を行うなど必要な対応を進め、特定臨床研究の実施計画等の国への届出をオンライン化した。
研究の信頼性確保
1.透明性の確保
(3)重大な不適合の取扱いについて
※ 実施医療機関の管理者は、特定臨床研究において重大な不適合の発生を知ったときは、その旨を公表すべきことについて通知を行った。
(令和4年3月31日 医政局研究開発振興課長通知)
2.研究の質の確保
(1)臨床研究審査委員会の認定要件について
※ CRBの更新要件について省令改正を行い、一定の経過措置を設けた上で、新規の審議件数は3年間で6件以上(ただし、毎年1件以上)、かつ、開
催回数については毎年7回以上に見直しを行った。(令和4年3月31日 省令改正)
※ 更新要件を満たさないCRBについては、円滑な廃止に向けて準備を進めていただくものとし、これまでに発出したCRBの更新に係る事務連絡を廃止した上
で、改めてCRBの更新に関する考え方を示した。(令和4年3月31日医政局研究開発振興課 事務連絡)
6