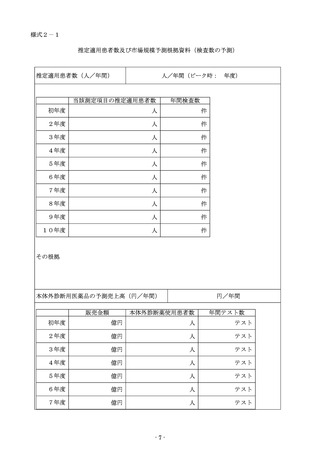
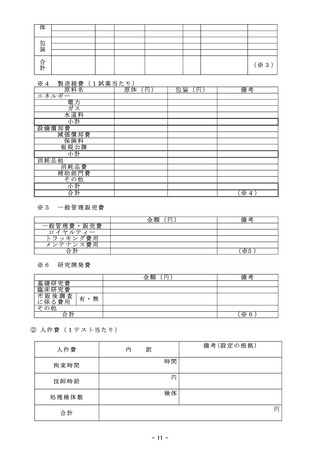
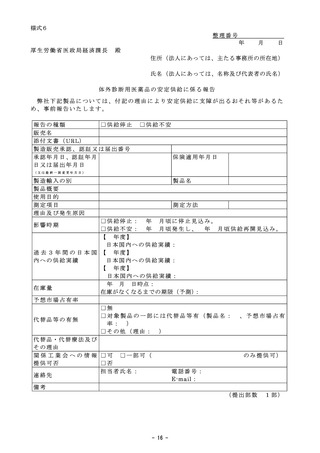
総ー4参考3○令和6年度保険医療材料制度の見直しについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00240.html |
| 出典情報 | 中央社会保険医療協議会 総会(第579回 1/17)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ロ 外国の医療材料の国別の価格(イに該当する場合は、イにおける最高の価格を除く。)が3
ヵ国以上あり、そのうち最高の価格がそれ以外の価格を相加平均した額の 1.6 倍を上回る場合、
当該最高の価格をそれ以外の価格を相加平均した額の 1.6 倍に相当する額とみなした上で各国の
外国の医療材料の価格を相加平均した額を、外国平均価格とみなす。
23
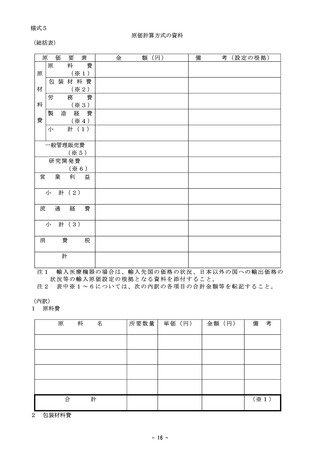
市場実勢価格加重平均値一定幅方式
市場実勢価格加重平均値一定幅方式とは、当該機能区分に属する全ての既収載品(材料価格調
査時以降に保険適用されたことその他の理由により、材料価格調査により市場実勢価格が把握で
きない既収載品及び第3章第4節に該当する新規収載品を除く。)の市場実勢価格、消費税率そ
の他を考慮した別表3に定める算式により行う原則的な基準材料価格の改定方式をいう。
24
外国平均価格に基づく再算定
外国平均価格に基づく再算定とは、基準材料価格の改定において、市場実勢価格加重平均値一
定幅方式に代えて、別表4に定める算式により基準材料価格を算定する方式をいう。
25
市場拡大再算定
市場拡大再算定とは、適応追加等により年間販売額が基準年間販売額の一定倍数を超えた既存
機能区分に適用する別表5に定める算式により基準材料価格を算定する方式をいう。
26
医療ニーズの高い医療機器等の早期導入に関する検討会に係る評価を行う場合の要件
医療ニーズの高い医療機器等の早期導入に関する検討会(以下「ニーズ検討会」という。)に
おける検討結果を踏まえ厚生労働省が行った開発要請又は公募に応じて開発されたものについて
評価を行う場合に必要な要件とは、以下の全ての要件を満たす場合をいう。
イ 医療ニーズの高い医療機器として選定されてから3年以内に薬事承認申請(医薬品医療機器
等法第 23 条の2の5第1項に規定する製造販売の承認を得るために申請することをいう。以下
同じ。)がなされたものであること。
ロ 総審査期間(医薬品医療機器等法第 23 条の2の5第1項に規定する製造販売の承認を得るま
での期間をいう。以下同じ。)について、申請者側の期間が新医療機器の優先品目又は改良医
療機器の臨床ありの場合は 120 日以内、新医療機器の通常品目の場合は 210 日以内であること。
ハ 承認(医薬品医療機器等法第 23 条の2の5第1項に規定する製造販売の承認のことをいう。
以下同じ。)又は認証(医薬品医療機器等法第 23 条の2の 23 第1項に規定する製造販売の認証
のことをいう。以下同じ。)を受けた日から保険適用希望書の提出までの期間が 120 日以内であ
ること。
27
再製造単回使用医療機器
再製造単回使用医療機器(以下「再製造品」という。)とは、単回使用の医療機器(一回限り使
用できることとされている医療機器をいう。以下同じ。)のうち、再製造(単回使用の医療機器
が使用された後、新たに製造販売をすることを目的として、これに検査、分解、洗浄、滅菌その
他必要な処理を行うことをいう。以下同じ。)をされたもので、原型医療機器(再製造の用に供
される単回使用の医療機器であって、未だ再製造されていないものをいう。以下同じ。)と同等
の品質、有効性及び安全性を有し、原型医療機器と使用目的又は効果が同様の医療機器をいう。
第2章 特定保険医療材料の保険償還価格
第1節 保険償還価格の原則
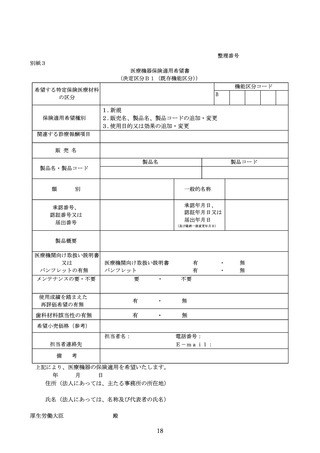
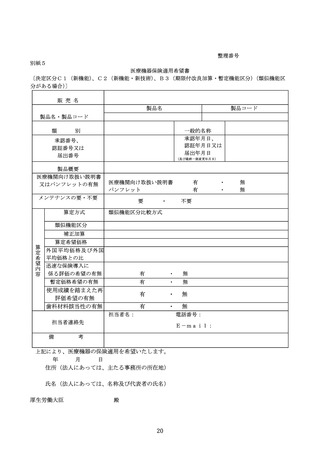
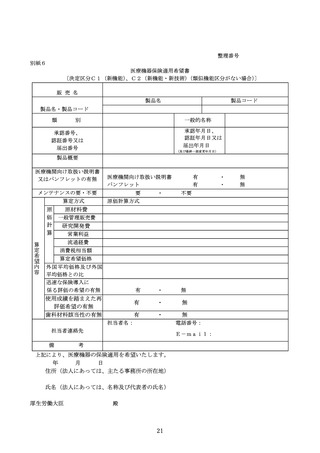
特定保険医療材料の保険償還価格は、当該特定保険医療材料が属する機能区分(「医療機器の
保険適用等に関する取扱いについて」(令和4年2月9日医政発 0209 第3号、保発 0209 第4号)
5(2)に基づき、当該機能区分の基準の見直しが行われる場合を含む。)の基準材料価格とす
る。
4