よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて(報告) 総ー6参考3 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00231.html |
| 出典情報 | 中央社会保険医療協議会 総会(第572回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.
臨床成績
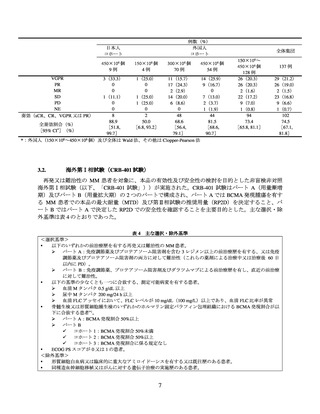
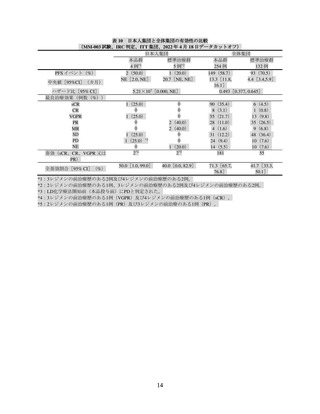
再発又は難治性の多発性骨髄腫(MM)の承認時に評価した主な臨床試験の成績を示す。
【有効性】
3.1.
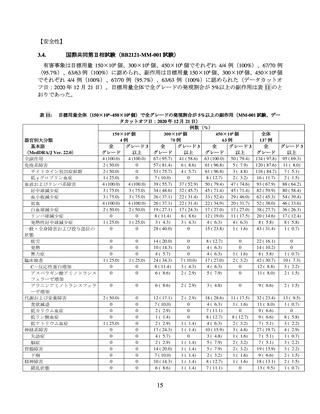
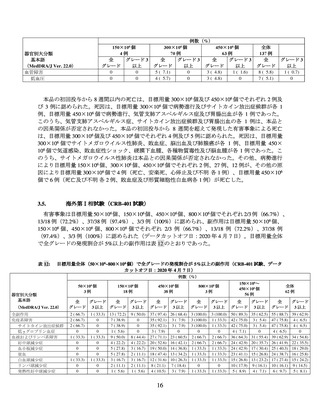
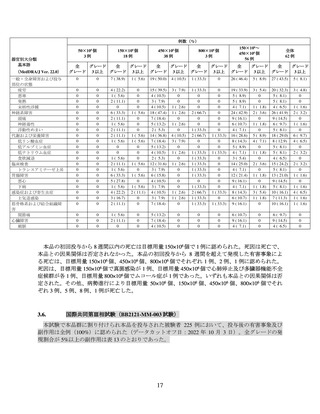
国際共同第Ⅱ相試験(BB2121-MM-001 試験)
再発又は難治性の MM 患者を対象に、本品の有効性及び安全性の検討を目的とした非盲検非対照
国際共同第Ⅱ相試験(以下、「MM-001 試験」)が実施された。主な選択・除外基準は表 1 のとおり
であった。
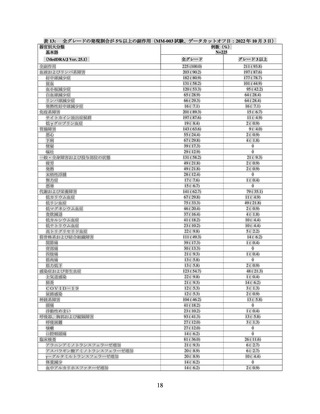
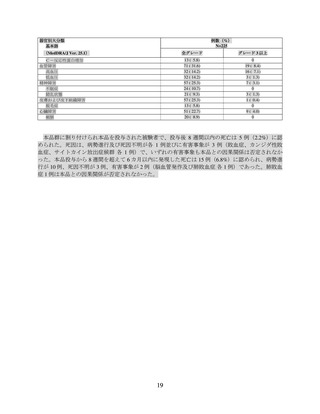
表1 主な選択・除外基準
<選択基準>
以下の前治療歴を有する再発又は難治性の MM 患者。
➢
MM に対する前治療を 3 レジメン以上受けている(導入療法は造血幹細胞移植及び維持療法の有無を問
わず 1 レジメンとする)。
➢
各レジメンの治療サイクルは、最良治療効果が PD でなければ、連続 2 サイクル以上受けていなければ
ならない。
➢
免疫調節薬、プロテアソーム阻害剤及び抗 CD38 抗体による前治療歴を有する。
➢
直近の前治療に対して難治性(治療中又は治療後 60 日以内に PD 確認)。
以下の基準の少なくとも 1 つに合致する測定可能病変を有する患者。
➢
血清 M タンパク 1.0 g/dL 以上
➢
尿中 M タンパク 200 mg/24 h 以上
➢
血清 FLC アッセイにおいて、FLC レベルが 10 mg/dL(100 mg/L)以上であり、血清 FLC 比率が異常
ECOG PS が 0 又は 1 の患者。
<除外基準>
形質細胞白血病、ワルデンストレーム・マクログロブリン血症、POEMS 症候群又は臨床的に重大なアミロ
イドーシスを有する又は既往歴のある患者。
同種造血幹細胞移植、がんに対する遺伝子治療、がんに対する細胞治療(自家骨髄移植及び自家末梢血幹細
胞移植は除く。)又は BCMA を標的とした治療の実施歴のある患者。
中枢神経系(CNS)に骨髄腫病変を有する患者。
臨床的に重大な中枢神経系(CNS)疾患の既往歴又は現病を有する患者。
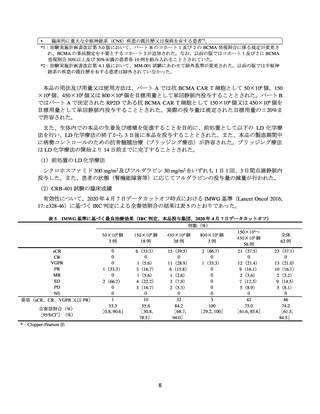
本品の用法及び用量又は使用方法は、外国人コホートでは抗 BCMA CAR T 細胞として 150×106
個、300×106 個又は 450×106 個1)を目標用量として単回静脈内投与することとされた。日本人コホ
ートでは全例で 450×106 個を目標用量として単回静脈内投与することとされた。
また、生体内での本品の生着及び増殖を促進することを目的に、前処置として以下の LD 化学療
法を行い、LD 化学療法の終了から 3 日後に本品を投与することとされた。また、本品の製造期間中
に病勢コントロールのための抗骨髄腫治療(ブリッジング療法)が許容された。ブリッジング療法
は LD 化学療法の開始より 14 日前までに完了することとされた。
(1)前処置の LD 化学療法
1) 実際の投与量の上限として、450×106 個の+20%の範囲内である 540×106 個までが許容範囲とされた。
5
臨床成績
再発又は難治性の多発性骨髄腫(MM)の承認時に評価した主な臨床試験の成績を示す。
【有効性】
3.1.
国際共同第Ⅱ相試験(BB2121-MM-001 試験)
再発又は難治性の MM 患者を対象に、本品の有効性及び安全性の検討を目的とした非盲検非対照
国際共同第Ⅱ相試験(以下、「MM-001 試験」)が実施された。主な選択・除外基準は表 1 のとおり
であった。
表1 主な選択・除外基準
<選択基準>
以下の前治療歴を有する再発又は難治性の MM 患者。
➢
MM に対する前治療を 3 レジメン以上受けている(導入療法は造血幹細胞移植及び維持療法の有無を問
わず 1 レジメンとする)。
➢
各レジメンの治療サイクルは、最良治療効果が PD でなければ、連続 2 サイクル以上受けていなければ
ならない。
➢
免疫調節薬、プロテアソーム阻害剤及び抗 CD38 抗体による前治療歴を有する。
➢
直近の前治療に対して難治性(治療中又は治療後 60 日以内に PD 確認)。
以下の基準の少なくとも 1 つに合致する測定可能病変を有する患者。
➢
血清 M タンパク 1.0 g/dL 以上
➢
尿中 M タンパク 200 mg/24 h 以上
➢
血清 FLC アッセイにおいて、FLC レベルが 10 mg/dL(100 mg/L)以上であり、血清 FLC 比率が異常
ECOG PS が 0 又は 1 の患者。
<除外基準>
形質細胞白血病、ワルデンストレーム・マクログロブリン血症、POEMS 症候群又は臨床的に重大なアミロ
イドーシスを有する又は既往歴のある患者。
同種造血幹細胞移植、がんに対する遺伝子治療、がんに対する細胞治療(自家骨髄移植及び自家末梢血幹細
胞移植は除く。)又は BCMA を標的とした治療の実施歴のある患者。
中枢神経系(CNS)に骨髄腫病変を有する患者。
臨床的に重大な中枢神経系(CNS)疾患の既往歴又は現病を有する患者。
本品の用法及び用量又は使用方法は、外国人コホートでは抗 BCMA CAR T 細胞として 150×106
個、300×106 個又は 450×106 個1)を目標用量として単回静脈内投与することとされた。日本人コホ
ートでは全例で 450×106 個を目標用量として単回静脈内投与することとされた。
また、生体内での本品の生着及び増殖を促進することを目的に、前処置として以下の LD 化学療
法を行い、LD 化学療法の終了から 3 日後に本品を投与することとされた。また、本品の製造期間中
に病勢コントロールのための抗骨髄腫治療(ブリッジング療法)が許容された。ブリッジング療法
は LD 化学療法の開始より 14 日前までに完了することとされた。
(1)前処置の LD 化学療法
1) 実際の投与量の上限として、450×106 個の+20%の範囲内である 540×106 個までが許容範囲とされた。
5