よむ、つかう、まなぶ。
資料2-1 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第68条の12の規定に基づく薬事・食品衛生審議会への副作用等報告について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
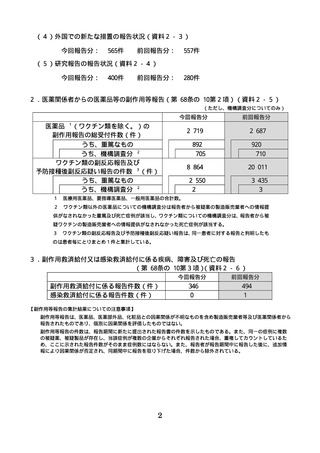
(4)外国での新たな措置の報告状況(資料2−3)
今回報告分:
565 件
前回報告分:
557 件
(5)研究報告の報告状況(資料2−4)
今回報告分:
400 件
前回報告分:
280 件
2.医薬関係者からの医薬品等の副作用等報告(第 68 条の 10 第2項)(資料2−5)
(ただし、機構調査分についてのみ)
今回報告分
前回報告分
2,719
2,687
※1
医薬品 (ワクチン類を除く。)の
副作用報告の総受付件数(件)
うち、重篤なもの
うち、機構調査分※2
ワクチン類の副反応報告及び
予防接種後副反応疑い報告の件数※3(件)
うち、重篤なもの
うち、機構調査分※2
892
705
8,864
920
710
20,011
2,550
2
3,435
3
※1
医療用医薬品、要指導医薬品、一般用医薬品の合計数。
※2
ワクチン類以外の医薬品についての機構調査分は報告者から被疑薬の製造販売業者への情報提
供がなされなかった重篤及び死亡症例が該当し、ワクチン類についての機構調査分は、報告者から被
疑ワクチンの製造販売業者への情報提供がなされなかった死亡症例が該当する。
※3
ワクチン類の副反応報告及び予防接種後副反応疑い報告は、同一患者に対する報告と判明したも
のは患者毎にとりまとめ1件と集計している。
3.副作用救済給付又は感染救済給付に係る疾病、障害及び死亡の報告
(第 68 条の 10 第3項)(資料2−6)
副作用救済給付に係る報告件数(件)
感染救済給付に係る報告件数(件)
今回報告分
前回報告分
346
0
494
1
【副作用等報告の集計結果についての注意事項】
○
副作用等報告は、医薬品、医薬部外品、化粧品との因果関係が不明なものを含め製造販売業者等及び医薬関係者から
報告されたものであり、個別に因果関係を評価したものではない。
副作用等報告の件数は、報告期間に新たに提出された報告書の件数を示したものである。また、同一の症例に複数
の被疑薬、被疑製品が存在し、当該症例が複数の企業からそれぞれ報告された場合、重複してカウントしているた
め、ここに示された報告件数がそのまま症例数にはならない。また、報告者が報告期間中に報告した後に、追加情
報により因果関係が否定され、同期間中に報告を取り下げた場合、件数から除外されている。
2
今回報告分:
565 件
前回報告分:
557 件
(5)研究報告の報告状況(資料2−4)
今回報告分:
400 件
前回報告分:
280 件
2.医薬関係者からの医薬品等の副作用等報告(第 68 条の 10 第2項)(資料2−5)
(ただし、機構調査分についてのみ)
今回報告分
前回報告分
2,719
2,687
※1
医薬品 (ワクチン類を除く。)の
副作用報告の総受付件数(件)
うち、重篤なもの
うち、機構調査分※2
ワクチン類の副反応報告及び
予防接種後副反応疑い報告の件数※3(件)
うち、重篤なもの
うち、機構調査分※2
892
705
8,864
920
710
20,011
2,550
2
3,435
3
※1
医療用医薬品、要指導医薬品、一般用医薬品の合計数。
※2
ワクチン類以外の医薬品についての機構調査分は報告者から被疑薬の製造販売業者への情報提
供がなされなかった重篤及び死亡症例が該当し、ワクチン類についての機構調査分は、報告者から被
疑ワクチンの製造販売業者への情報提供がなされなかった死亡症例が該当する。
※3
ワクチン類の副反応報告及び予防接種後副反応疑い報告は、同一患者に対する報告と判明したも
のは患者毎にとりまとめ1件と集計している。
3.副作用救済給付又は感染救済給付に係る疾病、障害及び死亡の報告
(第 68 条の 10 第3項)(資料2−6)
副作用救済給付に係る報告件数(件)
感染救済給付に係る報告件数(件)
今回報告分
前回報告分
346
0
494
1
【副作用等報告の集計結果についての注意事項】
○
副作用等報告は、医薬品、医薬部外品、化粧品との因果関係が不明なものを含め製造販売業者等及び医薬関係者から
報告されたものであり、個別に因果関係を評価したものではない。
副作用等報告の件数は、報告期間に新たに提出された報告書の件数を示したものである。また、同一の症例に複数
の被疑薬、被疑製品が存在し、当該症例が複数の企業からそれぞれ報告された場合、重複してカウントしているた
め、ここに示された報告件数がそのまま症例数にはならない。また、報告者が報告期間中に報告した後に、追加情
報により因果関係が否定され、同期間中に報告を取り下げた場合、件数から除外されている。
2