よむ、つかう、まなぶ。
資料1-8 医薬関係者からの医薬部外品等の副作用報告等の電子化について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
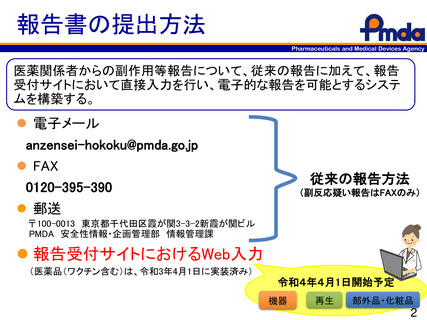
報告書の提出方法
Pharmaceuticals and Medical Devices Agency
医薬関係者からの副作用等報告について、従来の報告に加えて、報告
受付サイトにおいて直接入力を行い、電子的な報告を可能とするシステ
ムを構築する。
電子メール
anzensei-hokoku@pmda.go.jp
FAX
0120-395-390
郵送
従来の報告方法
(副反応疑い報告はFAXのみ)
〒100-0013 東京都千代田区霞が関3-3-2新霞が関ビル
PMDA 安全性情報・企画管理部 情報管理課
報告受付サイトにおけるWeb入力
(医薬品(ワクチン含む)は、令和3年4月1日に実装済み)
令和4年4月1日開始予定
機器
再生
部外品・化粧品
2
Pharmaceuticals and Medical Devices Agency
医薬関係者からの副作用等報告について、従来の報告に加えて、報告
受付サイトにおいて直接入力を行い、電子的な報告を可能とするシステ
ムを構築する。
電子メール
anzensei-hokoku@pmda.go.jp
FAX
0120-395-390
郵送
従来の報告方法
(副反応疑い報告はFAXのみ)
〒100-0013 東京都千代田区霞が関3-3-2新霞が関ビル
PMDA 安全性情報・企画管理部 情報管理課
報告受付サイトにおけるWeb入力
(医薬品(ワクチン含む)は、令和3年4月1日に実装済み)
令和4年4月1日開始予定
機器
再生
部外品・化粧品
2